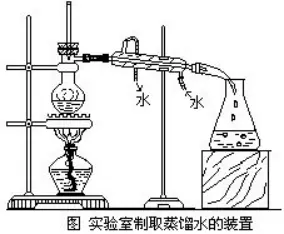
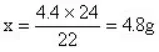ę╗�Īóį§śėšŲ╬š│Żė├╗»īW(xu©”)āxŲ„?
ū÷╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)ļx▓╗ķ_╩╣ė├╗»īW(xu©”)āxŲ„Ż¼į┌│§ųą╗»īW(xu©”)ųą│Ż╩╣ė├Ą─āxŲ„╝sČ■╩«ĘN�ĪŻ▀@ą®āxŲ„▓╗═¼ė┌╚š│Ż╔·╗Ņė├Š▀Ż¼ėą╦³ūį╝║Ą─├¹ĘQ║═╠žČ©Ą─╩╣ė├ĘĮĘ©���ĪŻ╩ūŽ╚æ¬(y©®ng)įōš²┤_ĄžĮą│÷╗»īW(xu©”)āxŲ„Ą─├¹ĘQ�Ż¼▓╗─▄ė├╔·╗Ņė├Š▀Ą─├¹ĘQ┤·╠µ╦³����ĪŻ└²╚ńŻ¼ėąĄ─īW(xu©”)╔·░č¤²▒ŁĮą▓Ż┴¦▒Ł�����Īó░čįć╣▄ŖAĮąŖAūėŻ¼╩Ū╩«ĘųÕe(cu©░)š`Ą─�ĪŻ
Ė„ĘN╗»īW(xu©”)āxŲ„Č╝ėąę╗Č©Ą─╩╣ė├ĘČć·ĪŻėąĄ─▓Ż┴¦āxŲ„┐╔ęį╝ė¤ßė├�Ż¼╚ńįć╣▄Īó¤²▒Ł�����Īó¤²Ų┐�����Īóš¶░l(f©Ī)├¾Ą╚;ėąĄ─▓╗─▄╝ė¤ß�����Ż¼╚ń┴┐═▓�Īó╝»ÜŌŲ┐Īó╦«▓█Ą╚����ĪŻėąĄ─āxŲ„┐╔ęįū÷┴┐Š▀ė├Ż¼╚ń═ą▒P╠ņŲĮ║═Ę©┤aė├üĒĘQ╚Ī╬’┘|(zh©¼)Ą─┘|(zh©¼)┴┐;┴┐═▓║═Ą╬Č©╣▄ė├üĒ┴┐╚Īę║¾wĄ─¾wĘe���ĪŻėąĄ─āxŲ„į┌īŹ(sh©¬)“×(y©żn)čbų├ųąŲų¦ō╬ū„ė├��Ż¼╚ńĶF╝▄┼_(t©ói)╝░ŲõĖĮ╝■ė├üĒų¦ō╬¤²Ų┐��Īó¤²▒Ł;╚²─_╝▄╝░ŲõĖĮ╝■ė├üĒų¦ō╬¤²▒Ł��Īóš¶░l(f©Ī)├¾�Īó█ßłÕĄ╚ĪŻėąą®āxŲ„═Ōė^║▄ŽÓ╦Ų��Ż¼╚▌ęū╗ņŽ²�Ż¼æ¬(y©®ng)įō═©▀^ī”▒╚╝ėęįĘų▐pĪŻ╚ń█ßłÕ║═š¶░l(f©Ī)├¾���Ż¼ųąīW(xu©”)īŹ(sh©¬)“×(y©żn)╩ę│ŻęŖ×ķ┤╔ųŲĄ─Ż¼═Ōė^ŽÓ╦Ų��ĪŻ█ßłÕĖĮėą█ßłÕ╔w���Ż¼š¶░l(f©Ī)├¾ø]ėą╔w;█ßłÕ╔ŽČ╦ø]ėą┴„ę║¾wė├Ą─╗Ē┐┌�����Ż¼Č°š¶░l(f©Ī)├¾ėą;█ßłÕ▌^Ė▀�Ż¼Č°š¶░l(f©Ī)├¾▌^Ą═����ĪŻėąĄ─īW(xu©”)╔·│Ż░čÅV┐┌Ų┐«ö(d©Īng)│╔╝»ÜŌŲ┐╩╣ė├�Ż¼Š═ę“?y©żn)ķø]ėąĖŃŪÕ╦³éāĄ─ģ^(q©▒)äe���ĪŻÅV┐┌Ų┐ĖĮėą╔w�Ż¼╩Ū╩ó╣╠¾w╦ÄŲĘĄ─╚▌Ų„;Č°╝»ÜŌŲ┐ø]ėą╔w�Ż¼│ŻĖ·▓Ż┴¦Ų¼┼õ╠ū╩╣ė├ĪŻ╝»ÜŌŲ┐Ų┐┐┌╔Ž▓┐��Ż¼Įø(j©®ng)▀^─ź╔░▒╚▌^ūµ▓┌��Ż¼─┐Ą─╩Ū═┐╔ŽĘ▓╩┐┴ų║¾į┘╔w╔Ž▓Ż┴¦Ų¼���Ż¼╩╣Ą├ÜŌ¾w▓╗═Ōę▌�����ĪŻČ°ÅV┐┌Ų┐Ų┐┐┌╔Ž▓┐���Ż¼ø]ėąĮø(j©®ng)▀^─ź╔░ĪŻ
╗»īW(xu©”)āxŲ„į┌ū÷╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)Ģr(sh©¬)Įø(j©®ng)│Żė├ĄĮ�����Ż¼īW(xu©”)Ģ■(hu©¼)š²┤_╩╣ė├▀@ą®āxŲ„Ą─ĘĮĘ©Ż¼╩Ū╩«Ęųųžę¬Ą─����ĪŻ├┐ĘNāxŲ„Ż¼Ė∙ō■(j©┤)╦³Ą─ė├═Š▓╗═¼�����Ż¼ėąų°▓╗═¼Ą─╩╣ė├ę¬Ū¾��ĪŻę“┤╦����Ż¼į┌╩╣ė├Ė„ĘN╗»īW(xu©”)āxŲ„Ū░Č╝æ¬(y©®ng)įō├„┤_╦³Ą─ę¬Ū¾╝░▀@ĘNę¬Ū¾Ą─įŁę“ĪŻ└²╚ń�����Ż¼╩╣ė├¤²▒ŁĢr(sh©¬)�����Ż¼×ķ┴╦Ę└ų╣öć░ĶĢr(sh©¬)ę║¾w×R│÷╗“ę║¾węń│÷�����Ż¼¤²▒Ł╦∙╩óę║¾w▓╗Ą├│¼▀^╦³Ą─╚▌ĘeĄ─2/3;×ķ┴╦Ę└ų╣ė╔ė┌╝ė¤ßĢr(sh©¬)╩▄¤ß▓╗Š∙ä“Č°╩╣¤²▒ŁŲŲ┴č�Ż¼╝ė¤ßŪ░ę¬░č╦³Ą─═Ō▒┌▓┴Ė╔Ż¼╝ė¤ßĢr(sh©¬)¤²▒ŁĄūę¬ē|╩»├▐ŠW(w©Żng)���ĪŻ╠žäe╩Ūę╗ą®╚▌ęū│÷¼F(xi©żn)Õe(cu©░)š`ė├Ę©Ą─āxŲ„�����Ż¼Ė³ąĶę¬╠žäeūóęŌ��ĪŻ└²╚ń�Ż¼ė├įć╣▄ŖAŖA│ųįć╣▄Ģr(sh©¬)���Ż¼ėąĄ─īW(xu©”)╔·░č─┤ųĖ░┤į┌ŖAĄ─╗Ņäė(d©░ng)▓┐Ęų�Ż¼į┌īŹ(sh©¬)“×(y©żn)▀^│╠ųą�����Ż¼ė╔ė┌▓╗ąĪą──┤ųĖ░┤äė(d©░ng)┴╦ŖAĄ─╗Ņäė(d©░ng)▓┐Ęų�Ż¼ų┬╩╣įć╣▄├ō┬õČ°┤“ŲŲĪŻę“┤╦�Ż¼╩╣ė├įć╣▄ŖAĢr(sh©¬)�����Ż¼ę╗Č©╩«ĘųūóęŌ─┤ųĖŪ¦╚f▓╗ę¬░┤į┌ŖAĄ─╗Ņäė(d©░ng)▓┐Ęų��ĪŻ
╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)║¾�����Ż¼ę¬╝░Ģr(sh©¬)Ž┤╦ó▓Ż┴¦āxŲ„��Ż¼▓┴╩├����Īóš¹└ĒŲõ╦³āxŲ„���ĪŻę“?y©żn)ķ�����Ż¼╚ń╗ņ╚ļļs┘|(zh©¼)═∙═∙Ģ■(hu©¼)ė░ĒæīŹ(sh©¬)“×(y©żn)ą¦╣¹ĪŻ╦∙ęį�����Ż¼ę¬Ū¾╦∙╩╣ė├Ą─āxŲ„▒žĒÜ╩ŪŪÕØŹĄ─Ż¼ėąą®īŹ(sh©¬)“×(y©żn)▀Ćę¬Ū¾╩ŪĖ╔į’Ą─�ĪŻ├┐┤╬ū÷═ĻīŹ(sh©¬)“×(y©żn)Ż¼æ¬(y©®ng)įō┴ó╝┤░čė├▀^Ą─▓Ż┴¦āxŲ„Ž┤ā¶�ĪŻ═©│ŻĘ┤Å═(f©┤)ė├╦«ø_Ž┤Äū┤╬Ż¼╚ń╣¹ā╚(n©©i)▒┌ĖĮėą▓╗ęūŽ┤ā¶Ą─╬’┘|(zh©¼)�Ż¼į┘ė├įć╣▄╦ó╦óŽ┤Ż¼╚ń╣¹ĖĮėą▓╗╚▄ąį╬’┘|(zh©¼)╗“ė═ų¼�Ż¼▀ĆąĶ╝ė¹}╦ß╗“¤ßēA╦óŽ┤ĪŻŽ┤ā¶Ą─įć╣▄æ¬(y©®ng)įōĘ┼į┌įć╣▄╝▄╔Ž┴└Ė╔����ĪŻ
Č■Īóį§śėšŲ╬š╗»īW(xu©”)╦ÄŲĘĄ─╩╣ė├?
īŹ(sh©¬)“×(y©żn)└’╦∙ė├Ą─╦ÄŲĘ���Ż¼ėąĄ─ėąČŠąį����Ż¼ėąĄ─ėąĖ»╬gąį����ĪŻę“┤╦Ż¼╚Īė├╗»īW(xu©”)╦ÄŲĘėąų°ć└(y©ón)Ė±Ą─ęÄ(gu©®)Č©�ĪŻę¬Ū¾ū÷ĄĮ“╚²▓╗”Ż¼▓╗─▄ė├╩ųĮėė|╦ÄŲĘ�����Ż¼▓╗ę¬░č▒Ū┐ū£ÉĄĮ╚▌Ų„┐┌╚ź┬äÜŌ¾wĄ─ÜŌ╬ČĪŻ▓╗įSćL╦ÄŲĘĄ─╬ČĄ└�ĪŻ
╚Īė├╦ÄŲĘŻ¼¤ošō╩Ū╚Ī┴┐��Īó▀Ć╩Ū╚ĪĘ©�����Ż¼Č╝ėąęÄ(gu©®)ĘČę¬Ū¾�ĪŻę╗ĘĮ├µę¬šŲ╬š╚Īė├Ą─ę¬ŅI(l©½ng);┴Ēę╗ĘĮ├µę▓æ¬(y©®ng)įōŪÕ│■▀`ęÄ(gu©®)Ą─╬Ż║”ĪŻ└²╚ń�Ż¼╚Īė├ę║¾w╦ÄŲĘŻ¼│ųŲ┐Ą─╩ų���Ż¼æ¬(y©®ng)įō░čś╦(bi©Īo)║׎“ų°╩ųą─���Ż¼ęį├ŌĄ╣═Ļ╦ÄŲĘ║¾Ż¼Üł┴¶į┌Ų┐┐┌Ą─╦Äę║┴„Ž┬üĒ�Ż¼Ė»╬gś╦(bi©Īo)║×ĪŻį┘╚ń�Ż¼░čēKĀŅ╣╠¾w╗“Įī┘Ņw┴ŻĘ┼▀M(j©¼n)įć╣▄Ż¼▓╗─▄═Č╚ļų▒┴óĄ─įć╣▄ā╚(n©©i)���Ż¼æ¬(y©®ng)įō░čįć╣▄ÖMĘ┼��Ż¼Ę┼╚ļ╣╠¾w║¾�Ż¼į┘└¹ė├ą▒├µ╗¼Ž┬ęį£pąĪ╦³Ą─ø_┴”�ĪŻ├ŌĄ├┤“ŲŲįć╣▄ĪŻįSČÓ╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)��Ż¼│Ż│ŻąĶę¬╚Īė├╝s┬į¾wĘeĄ─ę║¾w���Ż¼æ¬(y©®ng)įōīW(xu©”)Ģ■(hu©¼)╣└ę║Ą─╝╝─▄�����Ż¼ęį▒ŃšŲ╬šįć╣▄Ą─Ė▀Č╚┼cę║¾w¾wĘeĄ─┤ų┬įĻP(gu©Īn)ŽĄ���ĪŻ
įSČÓ╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)ąĶę¬╝ė¤ß╦ÄŲĘŻ¼╝ė¤ß╦ÄŲĘę▓ėąęÄ(gu©®)ĘČę¬Ū¾��ĪŻŽ±Įoįć╣▄└’ę║¾w╬’┘|(zh©¼)╝ė¤ß����Ż¼▓╗Ą½ī”╦ÄŲĘĄ─ė├┴┐Īó╗赥─▓┐╬╗�ĪóāAą▒Ą─ĮŪČ╚ėąų°├„┤_Ąžę¬Ū¾���ĪŻė╚Ųõī”░▓╚½▓┘ū„Ą─ę¬Ū¾Ż¼▓╗╚▌║÷ęĢ�����Ż¼╦∙╠ߥĮĄ─“Ž╚Š∙ä“����Īó║¾╝»ųąĪó╣▄┐┌╚f╬ī”ų°╚╦”╝ė¤ßĢr(sh©¬)ę╗Č©ę¬ū÷ĄĮ�ĪŻ
┤µĘ┼║═▒Ż╣▄╗»īW(xu©”)╦ÄŲĘŻ¼Ė∙ō■(j©┤)╦ÄŲĘĄ─ąį┘|(zh©¼)▓╔╚Īėąą¦Ą─▐kĘ©��ĪŻę╗░ŃüĒšf����Ż¼╚▄ę║ūŅ║├¼F(xi©żn)ė├¼F(xi©żn)┼õŻ¼▓╗ę╦ķLŲ┌┤µĘ┼���ĪŻėąĄ─╦ÄŲĘęŖ╣Ō����Īó╩ę£žĖ▀╚▌ęūūā┘|(zh©¼)Ż¼æ¬(y©®ng)įōĘ┼į┌║┌░Ą�����ĪóĄ═£žĄ─ĄžĘĮā”(ch©│)┤µ����ĪŻ╚ńŽ§╦ß��ĪóŽ§╦ßŃyĄ╚�����ĪŻėąĄ─╦ÄŲĘęŖ┐šÜŌęūč§╗»�Īóęū│▒ĮŌ╗“ęūĖ·Č■č§╗»╠╝Ę┤æ¬(y©®ng)Č°ūā┘|(zh©¼)Ż¼æ¬(y©®ng)įō├▄ĘŌ▒Ż┤µ�����ĪŻ└²╚ń����Ż¼¤²ēAĪóŠGĄ\Ą╚���ĪŻėąĄ─╦ÄŲĘėąäĪČŠ╗“ÅŖ(qi©óng)Ė»╬gąį�����Ż¼▀ĆėąĖ„ūįĄ─╠ž╩Ō▒Ż┤µĘĮĘ©�����ĪŻ
┴Ē═Ō����Ż¼▀Ćæ¬(y©®ng)šŲ╬šę╗ą®║åå╬ęūąąĄ─╠Ä└Ēė╔ė┌╦ÄŲĘĄ─ČŠąį╗“Ė»╬gąįČ°░l(f©Ī)╔·Ą─╩┬╣╩ĪŻ└²╚ń�����Ż¼▓╗╔„░čØŌ┴“╦ß×óį┌Ųż─w╔Ž�����Ż¼ę¬čĖ╦┘ė├▓╝░čØŌ┴“╦ß╩├╚ź��Ż¼▓┼─▄ė├╦«ø_Ž┤��ĪŻ
╚²�Īóį§śėšŲ╬š╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)Ą─╗∙▒Š▓┘ū„?
╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)Ą─╗∙▒Š▓┘ū„Ą─ĘNŅÉ║▄ČÓĪŻ└²╚ńŻ¼╝ė¤ß�����Īó╚▄ĮŌ�Īó▀^×VĪóš¶░l(f©Ī)����Īóš¶s���Īó╝»ÜŌ���ĪóĮY(ji©”)Š¦ĪóĄ╬Č©Ą╚�����ĪŻ═©│ŻĄ─╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)└’Č╝░³║¼ų°Ė„ĘN╗∙▒Š▓┘ū„��Ż¼ų╗ėąšŲ╬š┴╦╗∙▒Š▓┘ū„�Ż¼▓┼─▄ū÷║├╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)ĪŻ└²╚ń���Ż¼┤ų¹}Ą─╠ß╝ā░³└©┴╦╚▄ĮŌ����Īó▀^×VĪóš¶░l(f©Ī)Ą╚╗∙▒Š▓┘ū„�����ĪŻ
šŲ╬š╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)Ą─╗∙▒Š▓┘ū„���Ż¼╩ūŽ╚ę¬├„┤_▓┘ū„Ą─ę¬ŅI(l©½ng)║═Ą└└Ē����ĪŻ└²╚ń�����Ż¼╝ė¤ßĢr(sh©¬)��Ż¼æ¬(y©®ng)░č╩▄¤ßĄ─╬’┘|(zh©¼)Ę┼į┌═Ōčµ▓┐Ęų����Ż¼ę“?y©żn)ķŠŲŠ½¤¶Ą─╗čµėąčµą─Īóā?n©©i)čµ����Īó═Ōčµ╚²éĆ(g©©)▓┐Ęų�����Ż¼═Ōčµ╚╝¤²│õĘų�����Ż¼╦∙ęį£žČ╚Ė▀��ĪŻ╚ń╣¹Ę┼į┌赹─▓┐Ęų�����Ż¼╔§ų┴┼c¤¶ąŠĮėė|Ż¼ė╔ė┌▓Ż┴¦āxŲ„╩▄¤ß▓╗Š∙ä“�����Īó─▄░l(f©Ī)╔·ŲŲ┴č�ĪŻėąą®▌^Å═(f©┤)ļsĄ─▓┘ū„Ż¼ę¬įO(sh©©)Ę©╩╣ļyėøĄ─ę¬ŅI(l©½ng)ūāĄ├ęūėø��ĪŻ└²╚ń���Ż¼▀^×V▓┘ū„Ą─ę¬ŅI(l©½ng)┐╔ęįĖ┼└©×ķ“╚²Įėė|”��Īó“Č■Ą═ė┌”��Ż¼ęį▒Ńė┌ėøæø��ĪŻ╦³▒Ē╩Š▀^×VĢr(sh©¬)���Ż¼┬®ČĘĄ─Ž┬Č╦╣▄┐┌┐┐Šo“Įėė|”ĄĮ¤²▒ŁĄ─ā╚(n©©i)▒┌�����Īó▓Ż┴¦░¶Ą──®Č╦ę¬▌p▌pĄž“Įėė|”ĄĮėą╚²īė×V╝łĄ─ę╗▀ģ�Īó╩óæęØßę║Ą─¤²▒Ł┐┌ꬓĮėė|”ĄĮ▓Ż┴¦░¶╔Ž�Ż¼╩╣ę║¾wčžų°▓Ż┴¦░¶┴„▀M(j©¼n)▀^×VŲ„└’ĪŻ×V╝łĘ┼╚ļ┬®ČĘ└’���Ż¼×V╝łĄ─▀ģŠēæ¬(y©®ng)“Ą═ė┌”┬®ČĘ┐┌�����ĪóŽ“┬®ČĘ└’Ą╣╚ļĄ─ę║¾wĄ─ę║├µę¬“Ą═ė┌”×V╝łĄ─▀ģŠē����ĪŻ
╗∙▒Š▓┘ū„ų╗ėąĮø(j©®ng)▀^Ę┤Å═(f©┤)ŠÜ┴Ģ(x©¬)ĪóČÓ┤╬īŹ(sh©¬)█`▓┼─▄šµš²Ą─šŲ╬š�Ż¼▓╗─▄ų╗į┌│§īW(xu©”)Ģr(sh©¬)ūóęŌ╗∙▒Š▓┘ū„Ż¼æ¬(y©®ng)įōį┌Ė„ĘNīŹ(sh©¬)“×(y©żn)└’���Ż¼Č╝ųžęĢ╗∙▒Š▓┘ū„�ĪŻ└²╚ń�Ż¼čbų├ÜŌ├▄ąįĄ─Öz“×(y©żn)▓┘ū„Ż¼į┌ųŲĖ„ĘNÜŌ¾węįŪ░Č╝ę¬ū÷�Ż¼▓╗─▄┤µėąāeąęą─└ĒŻ¼┤²š²╩ĮųŲÜŌ¾wĢr(sh©¬)▓┼░l(f©Ī)¼F(xi©żn)┬®ÜŌ�����Ż¼Ę┤Č°čėš`┴╦Ģr(sh©¬)ķg����ĪŻ
╦─����Īóį§śėšŲ╬šÜŌ¾wĄ─īŹ(sh©¬)“×(y©żn)?
│§ųą╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)ųą░³└©┴╦ųŲ╚Īč§ÜŌĪóÜõÜŌ��ĪóČ■č§╗»╠╝╚²ĘNÜŌ¾w║═įć“×(y©żn)ÜõÜŌ▀ĆįŁąįĄ╚ÜŌ¾wīŹ(sh©¬)“×(y©żn)�ĪŻįSČÓīW(xu©”)╔·ū÷ÜŌ¾wīŹ(sh©¬)“×(y©żn)Ģr(sh©¬)�����Ż¼│Ż│ŻĖąĄĮ╩ų├”─_üy����ĪóŅÖ┤╦╩¦▒╦�Īóļyė┌┐žųŲĪŻ▀@┼cÜŌ¾wĘ┤æ¬(y©®ng)╦┘Č╚▌^┐ņ�Ż¼īŹ(sh©¬)“×(y©żn)£╩(zh©│n)éõ╣żū„▓╗ē“Ż¼▓┘ū„äė(d©░ng)ū„▓╗ģf(xi©”)š{(di©żo)Ą╚ėąĻP(gu©Īn)�����ĪŻ
ū÷ÜŌ¾wīŹ(sh©¬)“×(y©żn)ūŅ┼┬Ą─╩ŪīŹ(sh©¬)“×(y©żn)╬┤═Ļ│╔Č°ÜŌ¾wöÓį┤�����Ż¼ĮŌøQ▀@éĆ(g©©)å¢Ņ}Ą─▐kĘ©╩Ū��Ż¼░čųŲÜŌ¾wĄ─╦ÄŲĘĘ┼Ą├ē“ė├╗“┬įėą╩ŻėÓ���ĪŻ└²╚ńųŲč§Ģr(sh©¬)��Ż¼░č┬╚╦ßŌø║═Č■č§╗»ÕiĄ─╗ņ║Ž╬’╗“Ė▀Õi╦ßŌø£╩(zh©│n)éõūŃ┴┐�ĪŻųŲÜõĢr(sh©¬)Ż¼░čõ\┴Ż£╩(zh©│n)éõ▀^┴┐�����Ż¼¹}╦ß╗“ŽĪ┴“╦ßĘ┼į┌╩ų▀ģ�Ż¼ęįéõÜŌ┴„▓╗ūŃĢr(sh©¬)Ż¼ļSĢr(sh©¬)į÷╠Ēė├��ĪŻ┴Ē═Ōę¬ūóęŌĄ─╩Ū���Ż¼ū÷ÜŌ¾wīŹ(sh©¬)“×(y©żn)Ū░����Ż¼šJ(r©©n)šµÖz▓ķÜŌ├▄ąį�����Ż¼ęįĘ└īŹ(sh©¬)“×(y©żn)▀^│╠ųą┬®ÜŌ��ĪŻ
ė├┼┼╦«Ę©╩š╝»ÜŌ¾wŪ░����Ż¼æ¬(y©®ng)įō░č£╩(zh©│n)éõ╝»ÜŌė├Ą─╝»ÜŌŲ┐�Ż¼Ęųäe│õØM┴╦╦«����Ż¼▓óĄ╣┐█į┌╦«▓█Ą─╦«├µŽ┬����ĪŻ▓╗ꬥ╚ĄĮįō╩š╝»Ģr(sh©¬)Ż¼į┘Ž“╝»ÜŌŲ┐ųąūó╚ļ╦«╝╚ĄóöR┴╦Ģr(sh©¬)ķg�����Ż¼ėų░ū░ūĘ┼ū▀▓╗╔┘ÜŌ¾w����ĪŻ┴Ē═ŌŻ¼╦«▓█└’╩óĄ─╦«▓╗─▄╠½ČÓ���Ż¼ę╗░Ńęį░ļ▓█×ķę╦�����ĪŻ▓╗╚╗�Ż¼«ö(d©Īng)┼┼╦«╝»ÜŌĢr(sh©¬)�����Ż¼╝»ÜŌŲ┐└’Ą─╦«▀M(j©¼n)╚ļ╦«▓█├µ╩╣╦«ęń│÷ĪŻ×ķ┴╦▒Ńė┌╝»ÜŌ�����Ż¼ūŅ║├į┌╦«▓█└’Ę┼▀M(j©¼n)╝»ÜŌŲ┐ū∙��Ż¼░č│õØM╦«Ą─╝»ÜŌŲ┐Ę┼į┌Ų┐ū∙╔Ž���Ż¼▀@śė�����Ż¼┐╔ęį“v│÷ę╗ų¦╩ųüĒū÷Ųõ╦¹▓┘ū„�ĪŻ▀ĆąĶūóęŌī¦(d©Żo)ÜŌ╣▄╩Ūʱ─▄ņ`╗ŅęŲäė(d©░ng)���Ż¼╚ń▓╗ē“ņ`╗Ņ���Ż¼æ¬(y©®ng)įōšęšęįŁę“Ż¼▓ó▀M(j©¼n)ąąš{(di©żo)š¹╗“Ė³ōQ���ĪŻ
ū÷ÜŌ¾wīŹ(sh©¬)“×(y©żn)║═Ųõ╦³īŹ(sh©¬)“×(y©żn)ę╗śė�����Ż¼ę╗Č©ę¬ūóęŌ░▓╚½�����ĪŻ└²╚ń����Ż¼į┌╩š╝»═Ļč§ÜŌ║¾���Ż¼ę¬Ž╚░čī¦(d©Żo)ÜŌ╣▄Å─╦«├µ╚Ī│÷�Ż¼į┘ęŲķ_╝ė¤ßė├Ą─ŠŲŠ½¤¶���Ż¼ęį├Ō░l(f©Ī)╔·╦«▓█└’Ą─╦«─µ┴„▀M(j©¼n)╚ļįć╣▄░l(f©Ī)╔·╩┬╣╩�����ĪŻį┘╚ń���Ż¼³c(di©Żn)╚╝?x©¼)õÜŌŪ░Ż¼ę╗Č©ę¬Öz“×(y©żn)╝āČ╚���Ż¼ęįĘ└▒¼š©é¹╚╦��ĪŻ┴Ē═Ō����Ż¼Å─ą─└Ē╔ŽŻ¼ę¬ŪķŠwĘĆ(w©¦n)äė(d©░ng)�Ż¼┐╦Ę■┐ųæųĖąŻ¼▓┼─▄╩╣īŹ(sh©¬)“×(y©żn)ŠoÅłČ°ėąą“����Ż¼äė(d©░ng)ū„║═ųCĪó▀Bž×���ĪŻŪ¦╚f▓╗ꬹ·ćW�Īóµę¶[���Ż¼īŹ(sh©¬)“×(y©żn)Łh(hu©ón)Š│ļsüy����Īóų▒Įėė░Ēæų°īŹ(sh©¬)“×(y©żn)Ą─ą¦╣¹��ĪŻ
ū÷ÜõÜŌ(╗“ę╗č§╗»╠╝)▀ĆįŁč§╗»Ń~Ą╚▌^┤¾ą═ÜŌ¾wīŹ(sh©¬)“×(y©żn)���Ż¼ĮMčbāxŲ„Ģr(sh©¬)æ¬(y©®ng)Å─ū¾Ž“ėę�Ż¼Ž╚čbÜõÜŌ░l(f©Ī)╔·Ų„Ż¼į┘čb╝ė¤ßč§╗»Ń~Ą─čbų├�Ż¼ūŅ║¾ė├ī¦(d©Żo)ÜŌ╣▄▀BĮė╦³éāĪŻĮø(j©®ng)▀^Öz▓ķūC├„ÜŌ¾w┴„Ž“Ģ│═©�Ż¼▓┼─▄čb▀M(j©¼n)╦ÄŲĘū÷īŹ(sh©¬)“×(y©żn)�Ż¼▓╗ę¬╝▒ė┌Ū¾│╔ĪŻīŹ(sh©¬)“×(y©żn)▀^│╠�����Ż¼ę¬ć└(y©ón)Ė±ū±╩ž▓┘ū„ęÄ(gu©®)ät�Ż¼Ž╚═©ÜõÜŌŻ¼┼┼ā¶š¹éĆ(g©©)čbų├└’Ą─┐šÜŌ�Ż¼į┘╝ė¤ßč§╗»Ń~Ż¼┐┤ĄĮ├„’@īŹ(sh©¬)“×(y©żn)ą¦╣¹║¾���Ż¼ęŲķ_╝ė¤ßĄ─ŠŲŠ½¤¶�Ż¼└^└m(x©┤)═©ÜõÜŌų▒ĄĮ└õģs��ĪŻ
╬Õ����Īóį§śėšŲ╬š╠ß╝ā╬’┘|(zh©¼)Ą─ĘĮĘ©?
蹊┐╚╬║╬ę╗ĘN╬’┘|(zh©¼)Ą─ąį┘|(zh©¼)�����Ż¼Č╝▒žĒÜ╚Īė├╝āā¶╬’�����ĪŻę“?y©żn)ķę╗ĘN╬’┘|(zh©¼)└’╚ń╣¹║¼ėąļs┘|(zh©¼)�Ż¼Š═Ģ■(hu©¼)ė░Ēæ▀@ĘN╬’┘|(zh©¼)╣╠ėąĄ──│ą®ąį┘|(zh©¼)���ĪŻ╠ß╝ā╬’┘|(zh©¼)Ą─ĘĮĘ©��Ż¼æ¬(y©®ng)įōĖ∙ō■(j©┤)╗ņ║Ž╬’Ė„ĮMĘųĄ─ąį┘|(zh©¼)üĒ▀xō±�ĪŻĮY(ji©”)║ŽŠ▀¾wŪķør�����Ż¼┐╔ęįė├╬’└Ē╗“╗»īW(xu©”)Ą─ĘĮĘ©���Ż¼╩╣▓╗╝ā╬’┘|(zh©¼)ūā?y©Łu)ķ▒╚▌^╝āĄ─╬’┘|(zh©¼)���Ż¼╠ß╝ā╬’┘|(zh©¼)Ą─╬’└ĒĘĮĘ©Ż¼│ŻęŖĄ─ėą▀^×VĘ©����ĪóĮY(ji©”)Š¦Ę©��Īóš¶sĘ©��ĪóĘųę║Ę©�����Īó▌═╚ĪĘ©Ą╚��ĪŻ└²╚ńŻ¼īŹ(sh©¬)“×(y©żn)╩ęųŲč§ÜŌ║¾��Ż¼įć╣▄└’Üł┴¶Ą─Č■č§╗»Õi�����Ż¼┐╔ęį╠ß╚Ī│÷üĒ裣h(hu©ón)╩╣ė├���Ż¼ę¬╩╣╗ņ╚ļ┬╚╗»ŌøÅ─╗ņ║Ž╬’ųą│²╚ź�Ż¼┐╔▓╔ė├▀^×VĘ©�ĪŻę“?y©żn)ķ╗ņ║Ž╬’ųąĄ─Č■č§╗»Õi▓╗╚▄ė┌╦«Ż¼┬╚╗»Ōøęū╚▄ė┌╦«�ĪŻ
╚ń╣¹ė├╗»īW(xu©”)ĘĮĘ©╠ß╝ā╬’┘|(zh©¼)�����Ż¼æ¬(y©®ng)įōįO(sh©©)Ę©╩╣ļs┘|(zh©¼)ūā│╔ęū┼cų„ę¬ĮM│╔ĘųļxĄ─╬’┘|(zh©¼)�Ż¼╗“┼cų„ę¬ĮM│╔ŽÓ═¼Ą─╬’┘|(zh©¼)�ĪŻ▓╗ę¬Įø(j©®ng)╗»īW(xu©”)╠Ä└Ē║¾ėų╗ņ╚ļą┬Ą─ļs┘|(zh©¼)ĪŻ└²╚ń����Ż¼│²╚źę╗č§╗»╠╝ųą╗ņ╚ļĄ─Č■č§╗»╠╝ļs┘|(zh©¼)Ż¼┐╔ęįė├Üõč§╗»Ōc╚▄ę║Ž┤ÜŌ��Ż¼╩╣Č■č§╗»╠╝Ė·Üõč§╗»ŌcĘ┤æ¬(y©®ng)Č°╚▄ĮŌ�Ż¼┼cę╗č§╗»╠╝ĘųļxĪŻį┘╚ń�����Ż¼│²╚ź┬╚╗»Ōøųą╗ņ╚ļĄ─╠╝╦ßŌøļs┘|(zh©¼)���Ż¼┐╔ęįė├╝ė¹}╦ߥ─ĘĮĘ©��Ż¼╩╣╠╝╦ßŌøĖ·¹}╦ßĘ┤æ¬(y©®ng)ūā│╔Č■č§╗»╠╝?x©¼)Ō┼c┬╚╗»ŌøĘųļx����ĪŻ╝┘╚ńŻ¼░č¹}╦ßōQ│╔┴“╦ß�����Ż¼ļmę▓─▄Ė·╠╝╦ßŌøĘ┤æ¬(y©®ng)ūā│╔Č■č§╗»╠╝┼c┬╚╗»ŌøĘųļx���Ż¼╚╗Č°ę²╚ļ┴“╦ßĖ∙ļxūėą┬Ą─ļs┘|(zh©¼)����ĪŻ
K2CO3+2HCl=2KCl+CO2↑+H2O
K2CO3+H2SO4=K2SO4+CO2↑+H2O
┴∙��Īóį§śėšŲ╬šÖz“×(y©żn)╬’┘|(zh©¼)│╔ĘųĄ─īŹ(sh©¬)“×(y©żn)?
ė├īŹ(sh©¬)“×(y©żn)ĘĮĘ©Öz“×(y©żn)╬’┘|(zh©¼)Ą─│╔Ęų╦∙░³└©Ą─ĘNŅÉ║▄ČÓ��ĪŻ└²╚ń����Ż¼ęčų¬╬’┘|(zh©¼)│╔ĘųĄ─“×(y©żn)ūC���ĪóĶbČ©─│╬’┘|(zh©¼)ųą╩Ūʱ║¼ėą─│ĘN│╔Ęų���ĪóÄūĘN╬┤ų¬╬’Ą─ĶbäeĄ╚ĪŻ╩ūŽ╚����Ż¼æ¬(y©®ng)įō┼¬ŪÕ│■īŹ(sh©¬)“×(y©żn)╦∙ę¬Ū¾Ą─╩Ū──éĆ(g©©)ŅÉą═�Ż¼Ė∙ō■(j©┤)ę¬Ū¾üĒįO(sh©©)ėŗ(j©¼)īŹ(sh©¬)“×(y©żn)ĘĮĘ©�Ż¼╚╗║¾▓┼─▄äė(d©░ng)╩ųīŹ(sh©¬)“×(y©żn)ĪŻ
ęčų¬╬’┘|(zh©¼)│╔ĘųĄ─“×(y©żn)ūC�����ĪŻ╩Ūė├īŹ(sh©¬)“×(y©żn)ĘĮĘ©ūC├„─│ęčų¬╬’┘|(zh©¼)┤_īŹ(sh©¬)║¼ėą──ą®│╔Ęų�ĪŻ└²╚ńŻ¼“×(y©żn)ūC─æĄ\└’║¼ėąŃ~���Īó┴“╦ßĖ∙║═ĮY(ji©”)Š¦╦«�ĪŻĖ∙ō■(j©┤)─æĄ\Ą─ąį┘|(zh©¼)��Ż¼ė├ų▒Įė╝ė¤ßĘųĮŌĄ├ĄĮ¤o╦«┴“╦ßŃ~║═╦«�Ż¼ūC├„╦³║¼ėąĮY(ji©”)Š¦╦«;░č─æĄ\(╗“╩▄¤ßĘųĮŌ║¾Ą─¤o╦«┴“╦ßŃ~)╚▄ė┌┼õ│╔┴“╦ßŃ~╚▄ę║Ż¼╝ė╚ļ┬╚╗»õ^╔·│╔▓╗╚▄ė┌ŽĪŽ§╦ߥ─┴“╦ßõ^│┴ĄĒ�����Ż¼ūC├„╦³║¼ėą┴“╦ßĖ∙;ė├ĶFßö╗“õ\Ų¼Ę┼╚ļ┴“╦ßŃ~╚▄ę║─▄ų├ōQ│÷Įī┘Ń~���Ż¼ūC├„╦³║¼ėąŃ~�����ĪŻ
ĶbČ©─│╬’┘|(zh©¼)╩ŪʱĢ■(hu©¼)ėą─││╔Ęų��ĪŻæ¬(y©®ng)įō└¹ė├─││╔ĘųĄ─╠žš„Ę┤æ¬(y©®ng)╝ėęį┼ąöÓ����ĪŻ└²╚ńŻ¼ę¬å¢─│ĄV╩»╩Ūʱ║¼ėą╠╝╦ß¹}��Ż¼æ¬(y©®ng)įō└¹ė├╠╝╦ß¹}Ė·¹}╦ßĘ┤æ¬(y©®ng)─▄Ę┼│÷Č■č§╗»╠╝Ą─╠žš„Ę┤æ¬(y©®ng)��ĪŻį┘╚ń��Ż¼ę¬å¢─│╚▄ę║╩Ūʱ║¼ėą┬╚ļxūė�����Ż¼æ¬(y©®ng)įō└¹ė├Ž§╦ßŃy╚▄ę║└’Ą─Ńyļxūė�ĪóĖ·┬╚ļxūė─▄╔·│╔▓╗╚▄ė┌ŽĪŽ§╦ߥ─┬╚╗»Ńy│┴ĄĒĄ─╠žš„Ę┤æ¬(y©®ng)���ĪŻ
ĶbäeÄūĘN╬┤ų¬╬’┘|(zh©¼)����Ż¼æ¬(y©®ng)Ė∙ō■(j©┤)ÄūĘN╬’┘|(zh©¼)į┌═¼ę╗Ę┤æ¬(y©®ng)ųą▒Ē¼F(xi©żn)│÷Ą─▓╗═¼¼F(xi©żn)Ž¾(╗“▓╗Ę┤æ¬(y©®ng))╝ėęįģ^(q©▒)ĘųĪŻ▀xė├Ą─ĘĮĘ©ę¬║å▒Ńęūąą����ĪŻėąĢr(sh©¬)ę╗▓ĮĶbäe▓╗ķ_Ż¼▀ĆąĶā╔▓Į�����Īó╔§ų┴╚²▓Į��ĪŻ└²╚ń����Ż¼Ķbäeč§ÜŌĪóĄ¬?d©▓)Ō�ĪóÜõÜŌ║═Č■č§╗»╠╝╦─ĘNÜŌ¾wŻ¼ąĶę¬ā╔▓ĮĶbäe��Ż¼Ą┌ę╗▓Įė├ę╗Ė∙╚╝ų°Ą──ŠŚl����Ż¼ĘųäeĮėė|╦─ĘNÜŌ¾wŻ¼╩╣─ŠŚl╚╝¤²Ė³╝ėäĪ┴ęĄ─╩Ūč§ÜŌ�����Ż¼─▄░čÜŌ¾w³c(di©Żn)╚╝Ą─ÜõÜŌŻ¼╩╣╗赎©£ńĄ─Ą¬?d©▓)Ō║═Č■č§╗»╠╝��ĪŻąĶ▀M(j©¼n)ąąĄ┌Č■▓Į��Ż¼ė├│╬ŪÕĄ─╩»╗ę╦«Ķbäe��Ż¼╩╣╩»╗ę╦«ūā£åØߥ─╩ŪČ■č§╗»╠╝�����Ż¼┴Ēę╗ĘN╩ŪĄ¬?d©▓)ŌĪ?/p>
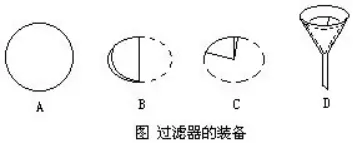
Ų▀���Īóį§śėū÷║├Č©┴┐īŹ(sh©¬)“×(y©żn)?
│§ųą╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)└’ėąą®ī┘ė┌Č©┴┐ĘĮ├µĄ─����Ż¼╚ń┼õųŲę╗Č©╚▄┘|(zh©¼)Ą─┘|(zh©¼)┴┐Ęų?j©½n)?sh©┤)
Ą─╚▄ę║�����Īó£yČ©Ž§╦ßŌøĄ─╚▄ĮŌČ╚Ą╚�ĪŻū÷Č©┴┐īŹ(sh©¬)“×(y©żn)Ū░Ż¼Ė∙ō■(j©┤)ę¬Ū¾╩┬Ž╚ėŗ(j©¼)╦Ń│÷ėąĻP(gu©Īn)öĄ(sh©┤)ō■(j©┤)�����ĪŻ└²╚ń���Ż¼ė├37%(├▄Č╚×ķ1.19g/cm3)Ą─ØŌ¹}╦ߎĪßī│╔200g20%Ą─ŽĪ¹}╦ß���ĪŻ╩ūŽ╚Ż¼ę¬Įø(j©®ng)▀^ėŗ(j©¼)╦ŃĮŌøQąĶė├ČÓ╔┘║┴╔²ØŌ¹}╦ß���Ż¼ČÓ╔┘║┴╔²╦«�ĪŻ

ū÷Č©┴┐īŹ(sh©¬)“×(y©żn)ę¬╩╣ė├═ą▒P╠ņŲĮ��Īó┴┐═▓Ą╚āxŲ„����ĪŻæ¬(y©®ng)įōšŲ╬š╬’┘|(zh©¼)Ą─ĘQ┴┐║═ę║¾wĄ─┴┐╚ĪĄ╚Č©┴┐īŹ(sh©¬)“×(y©żn)Ą─╗∙▒Š▓┘ū„ĪŻ└²╚ń���Ż¼╩╣ė├═ą▒P╠ņŲĮĢr(sh©¬)��Ż¼æ¬(y©®ng)ū¾▒PĘ┼ĘQ┴┐╬’�����Ż¼ėę▒PĘ┼Ē└┤a;ė├ĶćūėŖA╚ĪĘ©┤a;ė├╝łŲ¼╗“╚▌Ų„╩óĘ┼ĘQ┴┐╬’;╩╣ė├═Ļ«ģīóā╔▒PĘ┼į┌ę╗ŲĄ╚�ĪŻ
▀xō±┴┐Š▀Ģr(sh©¬)Ż¼ę¬ūóęŌ┼c╦∙ę¬ū÷Ą─Č©┴┐ŽÓ▀mæ¬(y©®ng)�����ĪŻ└²╚ń���Ż¼╩╣ė├┴┐═▓┴┐╚Īę╗Č©¾wĘeę║¾wĢr(sh©¬)�Ż¼Ė∙ō■(j©┤)ąĶę¬┴┐╚ĪĄ─ę║¾wĄ─¾wĘe���Ż¼▀xō±║Ž▀m┴┐│╠Ą─┴┐═▓�����ĪŻŽ¾╔Ž╩÷┼õųŲ20%ŽĪ¹}╦ß�Ż¼ę¬┴┐╚Ī90.91mLĄ─ØŌ¹}╦ß�ĪŻæ¬(y©®ng)įō▀xō±╚▌Ęe×ķ100mLĄ─┴┐═▓ĪŻ▓╗─▄▀xō±50mL┴┐═▓�����Ż¼Ęųā╔┤╬┴┐╚Ī��Ż¼Ė³▓╗─▄ė├10mL┴┐═▓Ż¼Ęų╩«┤╬┴┐╚Ī����ĪŻę“?y©żn)ķ�Ż¼ČÓ┤╬┴┐╚ĪĄ─▀^│╠ųąŻ¼ė╔ė┌▓┘ū„���Īóė^▓ņĄ╚ę²ŲĄ─š`▓Ņ┐é║═▒╚ę╗┤╬┴┐╚ĪĄ─┤¾�����ĪŻ┴Ē═Ō�Ż¼┴┐═▓ī┘ė┌▌^┤ų┬į┴┐╚Īę║¾w¾wĘeĄ─āxŲ„����Ż¼ę╗░Ńų╗─▄ė^▓ņŠ½┤_ĄĮš¹öĄ(sh©┤)╬╗Ż¼Ą┌ę╗╬╗ąĪöĄ(sh©┤)╩Ū╣└┴┐│÷üĒĄ─�����Ż¼▓╗ē“Š½┤_�����ĪŻę▓Š═╩ŪšfŻ¼īŹ(sh©¬)“×(y©żn)╩ę╦∙ė├Ą─100mL╚▌ĘeĄ─┴┐═▓���Ż¼▓╗┐╔─▄Š½┤_Ąž┴┐│÷90.91mLĄ─ØŌ¹}╦ß����Ż¼ų╗┤ų┬įĄĮ91mL(ūóŻ║│§ųąų╗ę¬Ū¾ė├┴┐═▓)����ĪŻū÷Č©┴┐īŹ(sh©¬)“×(y©żn)Ģr(sh©¬)Ż¼æ¬(y©®ng)įōūą╝Ü(x©¼)�����ĪóšJ(r©©n)šµ�����Ż¼▓╗ę¬×ó│÷��Ż¼Ą¶┬õ╗“╗ņ╚ļļs┘|(zh©¼)Č°ė░ĒæīŹ(sh©¬)“×(y©żn)Ą─Š½┤_Č╚����ĪŻ
░╦Īóį┌╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)ųąæ¬(y©®ng)ūóęŌ──ą®å¢Ņ}?
ė╔ė┌īŹ(sh©¬)“×(y©żn)╩ę└’╦∙ė├Ą─╗»īW(xu©”)╦ÄŲĘėąĄ─ėąČŠąį��ĪóėąĄ─ėąĖ»╬gąįĪŻę“┤╦į┌╗»īW(xu©”)╦ÄŲĘĄ─╩╣ė├ųąėąęįŽ┬┴∙éĆ(g©©)łį(ji©Īn)øQ▓╗£╩(zh©│n)įSĄ─å¢Ņ}��ĪŻ
(1)▓╗─▄ė├╩ųĮėė|╦ÄŲĘ�ĪŻ
(2)▓╗ę¬░č▒Ū┐ū£ÉĄĮ╚▌Ų„┐┌╚ź┬äÜŌ¾w╗“Ųõ╦³╣╠¾wĪóę║¾w╦ÄŲĘĄ─ÜŌ╬Č��ĪŻ
(3)▓╗įSćL╦ÄŲĘĄ─╬ČĄ└��ĪŻ
(4)īŹ(sh©¬)“×(y©żn)ė├╩ŻĄ─╦ÄŲĘę¬Į╗╗žīŹ(sh©¬)“×(y©żn)╩ę����Ż¼▓╗ę¬ÆüŚē����ĪŻ
(5)Å─įćä®Ų┐ųąĄ╣│÷Ą─ę║¾w╦ÄŲĘø]ėąė├═ĻŻ¼╩ŻėÓ▓┐Ęų▓╗įSĄ╣╗žįŁŲ┐ųą����Ż¼ęį├Ōė░Ēæ╦ÄŲĘĄ─╝āČ╚╗“ØŌČ╚ĪŻ
(6)īŹ(sh©¬)“×(y©żn)╩ęųąĄ─╦ÄŲĘ▓╗─▄┼▓ū„╦³ė├(╚ń╩│¹}����Īó░ū╠Ūę▓▓╗─▄Įo╚╬║╬╚╦«ö(d©Īng)š{(di©żo)╬ČŲĘė├)ĪŻ
1.╣╠¾w╦ÄŲĘ╚Īė├Ģr(sh©¬)æ¬(y©®ng)ūóęŌ──ą®å¢Ņ}?
(l)╚Īė├╣╠¾w╦ÄŲĘĢr(sh©¬)╦Ä│ū▒žĒÜ╩ŪĖ╔ā¶Ą─��ĪŻę╗ų¦╦Ä│ū▓╗─▄═¼Ģr(sh©¬)╚Īė├ā╔ĘN╗“ā╔ĘNęį╔ŽĄ─įćä®ĪŻ╦Ä│ū├┐╚Ī═Ļę╗ĘNįćä®║¾Č╝▒žĒÜė├Ė╔ā¶Ą─╝ł▓┴╩├Ė╔ā¶�Ż¼ęįéõŽ┬┤╬╩╣ė├ĪŻ╦Ä│ūĄ─ā╔Č╦×ķ┤¾ąĪā╔│ū��Ż¼╚Ī╣╠¾w┴┐▌^ČÓĢr(sh©¬)ė├┤¾│ū�Ż¼▌^╔┘Ģr(sh©¬)ė├ąĪ│ūĪŻ
(2)═∙įć╣▄└’čb╚ļ╣╠¾wĘ█─®Ģr(sh©¬)�����Ż¼×ķ▒▄├Ō╦ÄŲĘš┤į┌╣▄┐┌║═╣▄▒┌╔Ž�Ż¼įć╣▄æ¬(y©®ng)āAą▒Ż¼░č╩óėą╦ÄŲĘĄ─╦Ä│ūąĪą─Ąž╦═╚ļįć╣▄Ąū▓┐���Ż¼╚╗║¾╩╣įć╣▄ų▒┴óŲüĒ���Ż¼ūī╦ÄŲĘ╚½▓┐┬õį┌Ąū▓┐Ī���Ż╗“?q©▒)óįć╣▄╦«ŲĮĘ┼ų├���Ż¼░č╣╠¾wĘ█─®Ę┼į┌š█»B│╔▓█ĀŅĄ─╝łŚl╔ŽŻ¼╚╗║¾╦═╚ļįć╣▄╣▄ĄūŻ¼╚Ī│÷╝łŚl�����Ż¼īóįć╣▄ų▒┴óŲüĒ��ĪŻ
(3)ēKĀŅ╣╠¾w╦ÄŲĘ(╚ńŌø���ĪóŌc���Īó░ū┴ūĪó┤¾└Ē╩»�Īó╩»╗ę╩»�Īóõ\┴ŻĄ╚)ąĶŽ╚ė├Ķćūė╚Ī│÷Ż¼ūóęŌĶćūė╩╣ė├═Ļęį║¾ę¬┴ó┐╠ė├Ė╔ā¶Ą─╝ł▓┴╩├Ė╔ā¶���Ż¼ęįéõŽ┬┤╬╩╣ė├��ĪŻ░čēKĀŅĄ─╦ÄŲĘ╗“├▄Č╚▌^┤¾Ą─Įī┘Ņw┴ŻĘ┼╚ļįć╣▄ųąĢr(sh©¬)�Ż¼æ¬(y©®ng)įōŽ╚░čįć╣▄ÖMĘ┼���Ż¼░č╦ÄŲĘ╗“Įī┘Ņw┴ŻĘ┼╚ļįć╣▄�ĪŻęį║¾Ż¼į┘░čįć╣▄┬²┬²ĄžžQ┴óŲüĒ���Ż¼╩╣╦ÄŲĘ╗“Įī┘Ņw┴ŻŠÅŠÅĄž╗¼ĄĮ╚▌Ų„Ą─Ąū▓┐�Ż¼ęį├Ō┤“ŲŲįć╣▄���ĪŻ
2.╚ń║╬īóę║¾w╦ÄŲĘĄ╣╚ļįć╣▄ųą?
ę║¾w╦ÄŲĘ═©│Ż╩óį┌╝Ü(x©¼)┐┌Ų┐└’�����ĪŻ╚Īė├Ą─Ģr(sh©¬)║“���Ż¼Ž╚░čŲ┐╚¹─├Ž┬Ż¼Ą╣Ę┼į┌ū└╔Ž�ĪŻ╚╗║¾ę╗╩ų─├ŲŲ┐ūė(ūóęŌŲ┐╔ŽĄ─ś╦(bi©Īo)║×æ¬(y©®ng)Ž“ų°╩ųą─Ż¼ęį├ŌĄ╣═Ļ╦ÄŲĘ║¾�����Ż¼Üł┴¶į┌Ų┐┐┌Ą─╦Äę║┴„Ž┬üĒ�Ż¼Ė»╬gś╦(bi©Īo)║×)Ż¼┴Ēę╗╩ų┬įą▒Ąž░čįć╣▄│ų║├����Ż¼╩╣Ų┐┐┌Šo░żų°įć╣▄┐┌����Ż¼░čę║¾wŠÅŠÅĄžĄ╣╚ļįć╣▄└’���ĪŻĄ╣│÷ę║¾wĄ─¾wĘeĄĮīŹ(sh©¬)“×(y©żn)╦∙ąĶöĄ(sh©┤)┴┐Ģr(sh©¬)×ķų╣���ĪŻ«ö(d©Īng)ąĶė├ę║¾wĄ╣═Ļ║¾Ż¼░čįć╣▄┐┌į┌Ų┐┐┌╠Ä▓õÄūŽ┬�����Ż¼╩╣Üł┴¶į┌Ų┐┐┌╠ÄĄ─╦Äę║ę▓┴„╚ļĄĮįć╣▄ųą�����ĪŻ╚╗║¾┴ó╝┤╔wŠoŲ┐╚¹���Ż¼░čŲ┐ūėĘ┼╗žįŁ╠ÄŻ¼▓óūóęŌ╩╣Ų┐╔ŽĄ─ś╦(bi©Īo)║׎“═Ō�����ĪŻ
3..╩╣ė├╗»īW(xu©”)įćä®æ¬(y©®ng)«ö(d©Īng)ūóęŌĄĮ──ą®å¢Ņ}?
(l)Ęųčb╣╠¾wįćä®Ģr(sh©¬)����Ż¼æ¬(y©®ng)īó╦³╩óĘ┼į┌Ħ╚¹Ą─ÅV┐┌Ų┐└’╗“Ħėą─ź┐┌▓Ż┴¦╚¹Ą─┤¾┐┌įćä®Ų┐ųą�����ĪŻ
(2)Ęųčbę║¾wįćä®Ģr(sh©¬)���Ż¼ę║¾wįćä®æ¬(y©®ng)╩óĘ┼į┌╝Ü(x©¼)┐┌Ų┐ųąŻ¼╗“Ħėą─ź┐┌▓Ż┴¦╚¹Ą─╝Ü(x©¼)┐┌Ų┐ųą����ĪŻ╔┘┴┐ę║¾w┐╔Ę┼į┌Ą╬Ų┐ųąĪŻęŖ╣ŌęūĘųĮŌĄ─ę║¾wįćä®▀Ćæ¬(y©®ng)ūóęŌĘ┼į┌ūž╔½Ą─įćä®Ų┐ųą���ĪŻÜõč§╗»ŌcĄ╚ÅŖ(qi©óng)ēAąį╚▄ę║æ¬(y©®ng)┘A┤µį┌ĦŽ─z╚¹(╗“╦▄┴Ž╚¹��Īó╗“▄ø─Š╚¹)Ą─╝Ü(x©¼)┐┌Ų┐└’(ę“╩╣ė├▓Ż┴¦╚¹║▄╚▌ęūįņ│╔Ų┐╚¹┼cŲ┐┐┌Ą─š│▀B)�����ĪŻ
( 3)ķ_åó╩óėąęūō]░l(f©Ī)Ą─ę║¾w(╚ńØŌ░▒╦«��ĪóØŌ¹}╦ß���ĪóØŌŽ§╦ß�Īóę║õÕĄ╚)įćä®Ų┐Ą─Ų┐╚¹Ģr(sh©¬)�Ż¼Ų┐┐┌▓╗─▄ī”ų°├µ▓┐Ż¼ė╚Ųõ▓╗─▄ī”ų°č█Š”���Ż¼ęįĘ└Ų┐╚¹ķ_åó║¾����Ż¼Ų┐ā╚(n©©i)š¶Ų¹ćŖ│÷é¹║”č█Š”╗“═©▀^┐┌▒Ū╬³╚ļ¾wā╚(n©©i)����ĪŻ
(4)īŹ(sh©¬)“×(y©żn)║¾Ą─Ę┤æ¬(y©®ng)╬’Üł?ji©Īn)³ĪóÅUę║▓╗─▄ļS▒ŃĄ╣Ą¶����Ż¼æ¬(y©®ng)Ą╣╚ļųĖČ©╚▌Ų„ā╚(n©©i)ĪŻ╠žäe╩Ūę╗ą®ęū╚╝�����ĪóėąÅŖ(qi©óng)Ė»╬gąį���ĪóėąČŠĄ─╬ŻļU(xi©Żn)ŲĘ(╚ń░ū┴ūĪóĮī┘Ōc�ĪóØŌ╦ß����ĪóėąÖC(j©®)╚▄ä®╝░ČŠŲĘĄ╚)▒žĒÜĮø(j©®ng)▀^═ū╔Ų╠Ä└Ē║¾�Ż¼▓┼─▄Ą╣╚ļÅUę║ĖūųąĪŻ
4.╩╣ė├▓Ż┴¦āxŲ„æ¬(y©®ng)ūóęŌ──ą®å¢Ņ}?
(l)┐╔ęį╝ė¤ßĄ─┴¦āxŲ„ėąįć╣▄��Īó¤²▒Ł����Īó¤²Ų┐(łAĄū¤²Ų┐ĪóŲĮĄū¤²Ų┐)��Īóš¶s¤²Ų┐(łAĄūš¶s¤²Ų┐�ĪóŲĮĄūš¶s¤²Ų┐)ĪóÕFą╬Ų┐��ĪŻ
(2)▓╗┐╔ęįė├ŠŲŠ½¤¶ų▒Įė╝ė¤ß�����Ż¼Č°į┌ē|╔Ž╩»├▐ŠW(w©Żng)ęį║¾┐╔ęį╝ė¤ßĄ─▓Ż┴¦āxŲ„ėą¤²▒Ł����Īó¤²Ų┐(łAĄū¤²Ų┐ĪóŲĮĄū¤²Ų┐)���Īóš¶s¤²Ų┐(łAĄūš¶s¤²Ų┐����ĪóŲĮĄūš¶s¤²Ų┐)ĪóÕFą╬Ų┐��ĪŻ
(3)åóŲš░l(f©Ī)╔·Ų„����Īó╝»ÜŌŲ┐Īó▒Ē├µ├¾�ĪóĖ╔į’╣▄▀@ą®▓Ż┴¦āxŲ„Ż¼į┌╩╣ė├Ģr(sh©¬)▓╗─▄╝ė¤ß�����Ż¼Ą½┐╔ęįį┌▓╗╝ė¤ßĄ─Śl╝■Ž┬��Ż¼į┌▀@ą®āxŲ„ųą▀M(j©¼n)ąą╗»īW(xu©”)Ę┤æ¬(y©®ng)��ĪŻ
(4)į┌╩╣ė├Ģr(sh©¬)▓╗─▄╝ė¤ß���Ż¼ę▓▓╗─▄į┌Ųõųą▀M(j©¼n)ąą╗»īW(xu©”)Ę┤æ¬(y©®ng)Ą─▓Ż┴¦āxŲ„ėąŻ║─zŅ^Ą╬╣▄�����ĪóĘųę║┬®ČĘ�����ĪóķLŅi┬®ČĘ����Īó╦«▓█����Īó┴┐═▓Īó╦ß╩ĮĄ╬Č©╣▄�ĪóēA╩ĮĄ╬Č©╣▄ĪóĖ╔į’Ų„���Īóįćä®Ų┐��ĪóĄ╬Ų┐�����Īó└õ─²╣▄�����ĪŻ
5..į§śėŽ┤╦ó▓Ż┴¦āxŲ„?
ū÷╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)▒žĒÜė├Ė╔ā¶Ą─▓Ż┴¦āxŲ„��Ż¼Ę±ätĢ■(hu©¼)ė░ĒæīŹ(sh©¬)“×(y©żn)Ą─ą¦╣¹���ĪŻū÷═ĻīŹ(sh©¬)“×(y©żn)║¾�����Ż¼æ¬(y©®ng)įō┴ó╝┤░čė├▀^Ą─▓Ż┴¦āxŲ„Ž┤╦óĖ╔ā¶����ĪŻ
Ž┤╦óįć╣▄╗“¤²Ų┐Ą─ĘĮĘ©╩ŪŽ╚ūó╚ļ░ļ╣▄╗“░ļŲ┐╦«����Ż¼╔į╔įė├┴”š±╩ÄŻ¼░č╦«Ą╣Ą¶����Ż¼šš▀@śė▀BŽ┤öĄ(sh©┤)┤╬ĪŻ╚ń╣¹ā╚(n©©i)▒┌ĖĮėą▓╗ęūŽ┤Ą¶Ą─╬’┘|(zh©¼)���Ż¼┐╔ęįė├įć╣▄╦óŽ┤���ĪŻ╦óŽ┤Ģr(sh©¬)���Ż¼╩╣įć╣▄╦óį┌╩óėą╦«Ą─įć╣▄╗“¤²Ų┐└’▐D(zhu©Żn)äė(d©░ng)╗“╔ŽŽ┬ęŲäė(d©░ng)Ż¼Ą½ė├┴”▓╗Ą├▀^├═�����Ż¼Ę±ät╚▌ęū░čįć╣▄Ąū┼¬ŲŲ�����ĪŻ
Įø(j©®ng)╔Ž╩÷╦óŽ┤║¾�Ż¼▓Ż┴¦āxŲ„└’╚įėąÜł┴¶╬’Ą─║██E���Ż¼ätę¬Ė∙ō■(j©┤)Üł┴¶╬’Ą─ąį┘|(zh©¼)▀xė├▀m«ö(d©Īng)?sh©┤)─╗»īW(xu©”)╦ÄŲĘüĒŽ┤£ņ�ĪŻ
▓Ż┴¦āxŲ„Ž┤╦óĖ╔ā¶Ą─ś╦(bi©Īo)£╩(zh©│n)╩Ūį┌▓Ż┴¦ā╚(n©©i)▒┌▒Ē├µĖĮų°Ą─╦«╩ŪŠ∙ä“Ą─�����Ż¼ą╬│╔ę╗īėŠ∙ä“Ą─╦«─ż��Ż¼▓Ż┴¦ā╚(n©©i)▒┌╔ŽĄ─╦«╝╚▓╗Š█│╔╦«Ą╬����Īóę▓▓╗│╔╣╔┴„Ž┬�����Ż¼▀@śė▓┼╦ŃŽ┤Ė╔ā¶┴╦�ĪŻ
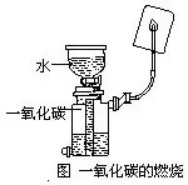
6..╩╣ė├š¶░l(f©Ī)├¾Ģr(sh©¬)æ¬(y©®ng)ūóęŌą®╩▓├┤?
(1)▀M(j©¼n)ąą╚▄ę║Ą─ØŌ┐s╗“?q©▒)ó╚▄ę║š¶░l(f©Ī)ų┴Ė╔Ģr(sh©¬)�Ż¼ąĶīóš¶░l(f©Ī)├¾Ę┼ų├į┌╚²─_╝▄╔Ž╗“ĶF╝▄┼_(t©ói)Ą─ĶF╚”╔ŽŻ¼┐╔ęįė├ŠŲŠ½¤¶ų▒Įė╝ė¤ß�����ĪŻ
(2)ØŌ┐s╚▄ę║Ģr(sh©¬)�����Ż¼į┌š¶░l(f©Ī)├¾ųą╚▄ę║Ą─┴┐ūŅČÓ▓╗ę¬│¼▀^╚▌ĘeĄ─╚²Ęųų«Č■�ĪŻ▀Ćæ¬(y©®ng)įōė├▓Ż┴¦░¶▓╗═ŻĄž▀M(j©¼n)ąąöć░ĶĪŻ
(3)╚¶ę¬░č╚▄ę║š¶░l(f©Ī)ų┴Ė╔�����Ż¼«ö(d©Īng)┐┤ĄĮš¶░l(f©Ī)├¾ųąėą┤¾┴┐╚▄┘|(zh©¼)╬÷│÷║¾�����Ż¼│²╚źæ¬(y©®ng)įōė├▓Ż┴¦░¶▓╗═ŻĄž└^└m(x©┤)öć░Ķ═ŌŻ¼▀Ćæ¬(y©®ng)įō│Ę╚źŠŲŠ½¤¶��Ż¼ė├ėÓ¤ß╩╣╚▄ę║š¶░l(f©Ī)ų┴Ė╔��Ż¼ęįĘ└ę“鄤ß▓╗║├Č°░l(f©Ī)╔·▒┼×R��ĪŻ
(4)▓╗▀mę╦į┌š¶░l(f©Ī)├¾ųąØŌ┐sÜõč§╗»ŌcĄ╚ÅŖ(qi©óng)ēA╚▄ę║����Ż¼ęį├Ōš¶░l(f©Ī)├¾ā╚(n©©i)▒┌Ą─ėį├µ╩▄ĄĮć└(y©ón)ųžĄ─Ė»╬g�����ĪŻ
(5)╚ĪĘ┼š¶░l(f©Ī)├¾Č╝æ¬(y©®ng)įōė├█ßÕüŃQŖAūĪęį║¾į┘╚ĪĘ┼�����ĪŻ
7..³c(di©Żn)╚╝ŠŲŠ½¤¶Ģr(sh©¬)×ķ╩▓├┤▓╗─▄ĄĮ┴Ēę╗éĆ(g©©)╚╝ų°Ą─ŠŲŠ½¤¶╔Žī”╗?
«ö(d©Īng)ė├╩ų─├ų°ę╗▒KŠŲŠ½¤¶ĄĮ┴Ēę╗éĆ(g©©)╚╝ų°Ą─ŠŲŠ½¤¶╔Ž├µ╚ź³c(di©Żn)╗Ģr(sh©¬)�Ż¼╩ų│ųĄ─ŠŲŠ½¤¶▒ž╚╗ę¬āAą▒Ż¼▀@śė╚▌Ų„ā╚(n©©i)Ą─ŠŲŠ½ę▓▒ž╚╗×ó│÷üĒ�Ż¼┴„į┌╚╝ų°Ą─ŠŲŠ½¤¶╔Ž├µČ°įņ│╔╩¦╗¼F(xi©żn)Ž¾ĪŻ×ķ┴╦▒▄├Ō╩¦╗¼F(xi©żn)Ž¾Ą─░l(f©Ī)╔·���Ż¼╦∙ęįĮ^ī”Į¹ų╣─├ŠŲŠ½¤¶ĄĮ┴Ēę╗ęčĮø(j©®ng)╚╝ų°Ą─ŠŲŠ½¤¶╔Ž╚ź³c(di©Żn)╗���ĪŻ
8.æ¬(y©®ng)įōį§śė╩╣ė├įć╣▄ŖA?
į┌Įoįć╣▄└’Ą─╬’┘|(zh©¼)╝ė¤ßĢr(sh©¬)���Ż¼Š═ąĶę¬╩╣ė├įć╣▄ŖAĪŻė├įć╣▄ŖAŖA│ųįć╣▄Ą─š²┤_▓┘ū„ĘĮĘ©╩Ūīóįć╣▄ŖAÅ─įć╣▄Ą─Ąū▓┐═∙╔Ž╠ū�����ĪŻŖAį┌įć╣▄Ą─ųą╔Ž▓┐����ĪŻ╚¶īóįć╣▄ķLČ╚╚²Ą╚ĘųĢr(sh©¬)Ż¼ätįć╣▄ŖAŖAį┌┐┐Į³įć╣▄┐┌Ą──ŪČ╦╚²Ęųų«ę╗Ą─▓┐╬╗ęįā╚(n©©i)×ķ║Ž└Ē�����ĪŻė├╩ų─├įć╣▄ŖAĢr(sh©¬)���Ż¼ę¬ūóęŌė├╩ų─├ūĪįć╣▄ŖAĄ─ķL▒·��Ż¼▓╗ę¬░č─┤ųĖ░┤į┌Č╠▒·╔Ž�ĪŻ
9.Įoįć╣▄└’Ą─╣╠¾w╦ÄŲĘ╝ė¤ßĢr(sh©¬)æ¬(y©®ng)ūóęŌą®╩▓├┤?
Įoįć╣▄└’Ą─╣╠¾w╦ÄŲĘ╝ė¤ßĢr(sh©¬)��Ż¼═∙═∙ėą╦«Ų¹«a(ch©Żn)╔·(Ę┤æ¬(y©®ng)▀^│╠ųą╔·│╔Ą─╦«╗“╦ÄŲĘųąĄ─ر┤µ╦«)�����Ż¼ę“┤╦įć╣▄┐┌▒žĒÜ╬óŽ“Ž┬āAą▒(╚ńłD╦∙╩Š)ĪŻ
╝ė¤ßŪ░ąĶŽ╚īóįć╣▄═Ō▒┌▓┴Ė╔�����Ż¼ęįĘ└ų╣╝ė¤ßĢr(sh©¬)įć╣▄š©┴č��ĪŻ╝ė¤ßĢr(sh©¬)æ¬(y©®ng)Ž╚╩╣įć╣▄Š∙ä“╩▄¤ß����Ż¼╩╣įć╣▄į┌ŠŲŠ½¤¶╔ŽęŲäė(d©░ng)ĪŻ
╚ń╣¹įć╣▄ęč╣╠Č©į┌ĶF╝▄┼_(t©ói)╔Ž�Ż¼ät┐╔ė├╩ų│ųŠŲŠ½¤¶į┌įć╣▄Ž┬ęŲäė(d©░ng)���Ż¼ęį▒ŻūCįć╣▄╩▄¤ßŠ∙ä“����ĪŻ
┤²įć╣▄Š∙ä“╩▄¤ß║¾�Ż¼īóŠŲŠ½¤¶╗čµ╣╠Č©į┌įć╣▄ųąĘ┼ėą╣╠¾w╦ÄŲĘĄ─▓┐╬╗Ż¼╩╣╣╠¾w╦ÄŲĘ│õĘų╩▄¤ß�Ż¼ęį└¹ė┌Ę┤æ¬(y©®ng)Ą─Ēś└¹▀M(j©¼n)ąąĪŻ
į┌š¹éĆ(g©©)╝ė¤ß▀^│╠ųą��Ż¼▓╗ę¬╩╣įć╣▄Ė·¤¶ąŠĮėė|Ż¼ęį├Ōįć╣▄š©┴č�����ĪŻ
Įoįć╣▄└’Ą─ę║¾w╦ÄŲĘ╝ė¤ßĢr(sh©¬)æ¬(y©®ng)ūóęŌą®╩▓├┤?
Įoįć╣▄└’Ą─ę║¾w╦ÄŲĘ╝ė¤ßĢr(sh©¬)����Ż¼ę¬ė├įć╣▄ŖAŖAūĪįć╣▄Ż¼╗“?q©▒)óįć╣▄ė├ĶFŖA╣╠Č©į┌ĶF╝▄┼_(t©ói)╔Ž╚ńłD╦∙╩Š�����ĪŻ
įć╣▄ųąę║¾w╦ÄŲĘĄ─¾wĘe▓╗ę¬│¼▀^įć╣▄╚▌ĘeĄ─╚²Ęųų«ę╗�����Ż¼ęįĘ└į┌╝ė¤ß▀^│╠ųą╗“ę║¾wĘą“vĢr(sh©¬)����Ż¼ėąę║¾w╦ÄŲĘÅ─įć╣▄ųąę▌│÷ĪŻ
╝ė¤ßŪ░ąĶŽ╚īóįć╣▄═Ō▒┌▓┴Ė╔����Ż¼ęįĘ└╝ė¤ßĢr(sh©¬)įć╣▄š©┴čĪŻ
╝ė¤ßĢr(sh©¬)���Ż¼įć╣▄ę¬āAą▒����Ż¼āAą▒ĮŪČ╚æ¬(y©®ng)×ķ┼cū└├µ│╔45°ĮŪ×ķ▀mę╦ĪŻ
╝ė¤ßĢr(sh©¬)�����Ż¼æ¬(y©®ng)Ž╚╩╣įć╣▄Š∙ä“╩▄¤ß�����Ż¼╚╗║¾ąĪą─ĄžĮoįć╣▄└’Ą─ę║¾wĄ─ųąŽ┬▓┐╬╗╝ė¤ß�Ż¼▓óŪę▓╗Ģr(sh©¬)Ąž╔ŽŽ┬ęŲäė(d©░ng)įć╣▄ĪŻ«ö(d©Īng)įć╣▄▒╗╣╠Č©į┌ĶF╝▄┼_(t©ói)╔Ž��Ż¼ät╩ų│ųŠŲŠ½¤¶��Ż¼į┌įć╣▄╩óĘ┼ę║¾wĄ─ųąŽ┬▓┐╬╗╠Ä�����Ż¼▓╗Ģr(sh©¬)Ąž╔ŽŽ┬ęŲäė(d©░ng)ŠŲŠ½¤¶�����ĪŻ
į┌š¹éĆ(g©©)╝ė¤ß▀^│╠ųą�����Ż¼▓╗ę¬╩╣įć╣▄Ė·¤¶ąŠĮėė|���Ż¼ęį├Ōįć╣▄š©┴č��ĪŻ
×ķ▒▄├Ōįć╣▄└’ę║¾wĘą“vćŖ│÷é¹╚╦�Ż¼╝ė¤ßĢr(sh©¬)Ūą▓╗┐╔╩╣įć╣▄┐┌ī”ų°ūį╝║╗“┼į╚╦�ĪŻ
10.──ą®Õe(cu©░)š`Ą─▓┘ū„─▄ī¦(d©Żo)ų┬įć╣▄š©┴č?
ėąęįŽ┬Š┼ĘNÕe(cu©░)š`ĪŻ
(1)ŖA│ųįć╣▄Ą─ĶFŖA▀^Šo����Ż¼╬┤┴¶│÷įć╣▄╩▄¤ß┼“├øĄ─ėÓĄžŻ¼╩╣įć╣▄╩▄¤ß┼“├ø░l(f©Ī)╔·š©┴č�ĪŻ
(2)įć╣▄═Ō▒┌ėą╦«╬┤▓┴Ė╔ĪŻ«ö(d©Īng)╝ė¤ßĢr(sh©¬)įć╣▄═Ō▒┌ėąĄ─ĄžĘĮŽ╚Ė╔į’��Ż¼ėąĄ─ĄžĘĮ║¾Ė╔į’���Ż¼ė╔ė┌╩▄¤ß▓╗Š∙ä“����Ż¼Č°ę²Ųįć╣▄š©┴čĪŻ
(3)Įoįć╣▄ųąĄ─╣╠¾w╦ÄŲĘ╝ė¤ßĢr(sh©¬)���Ż¼įć╣▄┐┌ø]╔įŽ“Ž┬āAą▒�����Ż¼ė╔ė┌Ę┤æ¬(y©®ng)▀^│╠ųąėą╦«╔·│╔╗“įŁüĒ╣╠¾w╦ÄŲĘųą║¼ėąØ±┤µ╦«Ą─Šē╣╩�����Ż¼╦«Å─įć╣▄┐┌┴„Ž“įć╣▄ĄūČ°ę²Ųįć╣▄š©┴č�����ĪŻ
(4)Įoįć╣▄ųąĄ─ę║¾w╝ė¤ßĢr(sh©¬)����Ż¼įć╣▄ųąĄ─ę║¾w│¼▀^įć╣▄╚▌ĘeĄ─╚²Ęųų«ę╗����Ż¼╝ė¤ß▀^│╠ųąėąę║¾wÅ─įć╣▄ųąę▌│÷Č°×óį┌įć╣▄═Ō▒┌Č°ę²Ųįć╣▄š©┴č�ĪŻ
( 5)Įoįć╣▄╝ė¤ßĢr(sh©¬)Ż¼ø]Ž╚Įoš¹éĆ(g©©)įć╣▄Š∙ä“╩▄¤ß����Ż¼Č°╩Ūų▒ĮėĮoįć╣▄ųąĄ─Ę┼╦ÄŲĘ▓┐ĘųĄ─įć╣▄╠Ä╝ė¤ß����Ż¼Č°ę²Ųįć╣▄š©┴č��ĪŻ
(6)Įoįć╣▄╝ė¤ßĢr(sh©¬)����Ż¼ŠŲŠ½¤¶Ą─赹─┼cįć╣▄Įėė|Ż¼Č°ę²Ųįć╣▄š©┴č����ĪŻ
(7)¤²Ą├║▄¤ßĄ─įć╣▄Ę┼į┌ū└ūė╔Ž╗“įć╣▄╝▄╔ŽČ°ę²Ųįć╣▄š©┴čĪŻ
(8)īŹ(sh©¬)“×(y©żn)▀^│╠ųąėą└õĄ─ę║¾w×RĄĮ▒╗╝ė¤ßĄ─įć╣▄╔Ž╗“¤²Ą├║▄¤ßĄ─įć╣▄▀Ć╬┤└õģs����Ż¼╚ńė├└õ╦«ø_Ž┤║▄┐╔─▄│÷¼F(xi©żn)š©┴čĪŻ
(9)į┌ųŲ╚ĪÜŌ¾wĢr(sh©¬)��Ż¼ė├┼┼╦«╚ĪÜŌĘ©╩š╝»ÜŌ¾w�����Ż¼«ö(d©Īng)ÜŌ¾w╩š╝»═Ļ«ģ║¾Ż¼ø]ėą░čī¦(d©Żo)ÜŌ╣▄Å─╦«▓█ųą─├│÷üĒ��Ż¼▒ŃŽ╚│Ęū▀ŠŲŠ½¤¶��Ż¼╩╣└õ╦«čžī¦(d©Żo)ÜŌ╣▄▀M(j©¼n)╚ļįć╣▄ā╚(n©©i)��Ż¼Ģ■(hu©¼)ę²Ųįć╣▄š©┴č�����ĪŻ
ę²╔ĻŻ║į┌łD1Įoę║¾w╝ė¤ßčbų├ųąėą──ą®Õe(cu©░)š`?
łDųą╣▓ėą╦─╠ÄÕe(cu©░)š`���ĪŻ
(1)įć╣▄ųąĄ─ę║¾w▀^ČÓ���ĪŻįć╣▄ųąĄ─ę║¾wūŅČÓ×ķįć╣▄╚▌ĘeĄ─╚²Ęųų«ę╗ĪŻ
(2)įć╣▄▓╗æ¬(y©®ng)×ķžQų▒ĘĮŽ“��ĪŻįć╣▄æ¬(y©®ng)┼cū└├µ│╔45Č╚ĮŪ��ĪŻ
(3)ŠŲŠ½¤¶ā╚(n©©i)ŠŲŠ½┴┐╠½ČÓ����ĪŻŠŲŠ½¤¶ā╚(n©©i)ŠŲŠ½Ą─┴┐▓╗æ¬(y©®ng)│¼▀^╚▌ĘeĄ─╚²Ęųų«Č■ĪŻ
(4)įć╣▄ĄūęčĮø(j©®ng)Įėė|ŠŲŠ½¤¶Ą─¤¶ąŠ���Ż¼▀@śėįć╣▄╚▌ęūš©┴č��ĪŻæ¬(y©®ng)įōė├ŠŲŠ½¤¶Ą─═ŌčµĮoįć╣▄╝ė¤ß����ĪŻ
š²┤_łDą╬ęŖłD2���ĪŻ
11.ė├┴┐═▓┴┐╚Īę╗Č©¾wĘeĄ─ę║¾wĢr(sh©¬)æ¬(y©®ng)ūóęŌą®╩▓├┤?
ė├┴┐═▓┴┐╚Īę╗Č©¾wĘeĄ─ę║¾wĢr(sh©¬)��Ż¼ėąęįŽ┬╦─³c(di©Żn)æ¬(y©®ng)įōūóęŌ(╚ńłD╦∙╩Š)�����ĪŻ
(1)ė├┴┐║å┴┐╚Īę╗Č©¾wĘeĄ─ę║¾w╦ÄŲĘĢr(sh©¬)����Ż¼┴┐═▓▒žĒÜĘ┼ŲĮĘĆ(w©¦n)�����ĪŻ
(2)ė├įćä®Ų┐═∙┴┐═▓ųąāAĄ╣ę║¾wĢr(sh©¬)����Ż¼Ų┐┐┌ꬊo░ż┴┐═▓┐┌���Ż¼╩╣ę║¾wčžų°┴┐═▓ā╚(n©©i)▒┌ŠÅŠÅŽ“Ž┬┴„╚ļ┴┐═▓ųąĪŻ
(3)ė├─zŅ^Ą╬╣▄═∙┴┐═▓ā╚(n©©i)Ą╬╝ėę║¾wĢr(sh©¬)����Ż¼▓╗ę¬░č─zŅ^Ą╬╣▄╔ņ╚ļ┴┐═▓ā╚(n©©i)Ż¼Ė³▓╗įSĮėė|═▓▒┌��ĪŻ
(4)ūx╚Īę║¾w¾wĘeöĄ(sh©┤)Ģr(sh©¬)�����Ż¼▒žĒÜ╩╣ęĢŠĆ┼c┴┐═▓ā╚(n©©i)ę║¾wĄ─░╝ę║├µĄ─ūŅĄ═╠Ä▒Ż│ų╦«ŲĮ����Ż¼į┘ūx│÷ę║¾wĄ─¾wĘeöĄ(sh©┤)ĪŻ
12.╩╣ė├═ą▒P╠ņŲĮų«Ū░▒žĒÜū÷──ą®£╩(zh©│n)éõ╣żū„?
╩╣ė├═ą▒P╠ņŲĮų«Ū░▒žĒÜĄ─£╩(zh©│n)éõ╣żū„╩Ūš{(di©żo)┴Ń³c(di©Żn)�ĪŻ╝┤ĘQ┴┐Ū░Ž╚░čė╬┤aĘ┼į┌┐╠Č╚│▀Ą─┴Ń╠ÄŻ¼Öz▓ķ╠ņŲĮĄ─ö[äė(d©░ng)╩Ūʱ▀_(d©ó)ĄĮŲĮ║Ō��ĪŻ╚ń╣¹ęčĄĮ▀_(d©ó)ŲĮ║Ō�����Ż¼ųĖßśö[äė(d©░ng)Ģr(sh©¬)Ž╚║¾ųĖ╩ŠĄ─ś╦(bi©Īo)│▀╔ŽĄ─ū¾���Īóėęā╔▀ģĄ─Ė±öĄ(sh©┤)ĮėĮ³ŽÓĄ╚��Ż¼ųĖßśņoų╣Ģr(sh©¬)æ¬(y©®ng)ųĖį┌ś╦(bi©Īo)│▀Ą─ųąķg�ĪŻ╚ń╣¹╠ņŲĮĄ─ö[äė(d©░ng)╬┤▀_(d©ó)ĄĮŲĮ║ŌŻ¼┐╔ęįš{(di©żo)╣Ø(ji©”)ū¾���ĪóėęĄ─┬▌ĮzŻ¼╩╣ö[äė(d©░ng)▀_(d©ó)ĄĮŲĮ║Ō����ĪŻ
13.łD1▀^×Včbų├ųąėą──ą®Õe(cu©░)š`?
łDųą╣▓ėą╦─╠ÄÕe(cu©░)š`ĪŻ
(1)×V╝ł▀^┤¾��ĪŻ×V╝ł▓╗æ¬(y©®ng)│¼│÷┬®ČĘ┐┌ęį═Ō�����Ż¼×V╝łĄ─▀ģŠēꬥ═ė┌┬®ČĘ┐┌╝s5mm���Ż¼ČÓėÓĄ─×V╝łæ¬(y©®ng)╝¶╚ź�����ĪŻ
(2)▓Ż┴¦░¶æę┐š┴╦���Ż¼╬┤ė|╝░×V╝ł����ĪŻ▓Ż┴¦░¶æ¬(y©®ng)ė|╝░×V╝ł╚²š█Ą──Ūę╗▀ģ�ĪŻ
(3)āAĄ╣Ģr(sh©¬)▀^×Vę║¾wĄ─¤²▒Ł┐┌æ¬(y©®ng)Įėė|▓Ż┴¦░¶▓┼ī”ĪŻ
(4)┬®ČĘūņĄ─╝ŌŅ^▓┐Ęų╬┤Įėė|¤²▒Łā╚(n©©i)▒┌����ĪŻæ¬(y©®ng)īó┤╦┬®ČĘ╦«ŲĮĄžą²▐D(zhu©Żn)ę╗░┘░╦╩«Č╚Ż¼╩╣┬®ČĘūņĄ─╝ŌŅ^▓┐ĘųĮėė|¤²▒Łā╚(n©©i)▒┌�����ĪŻš²┤_łDą╬ęŖłD2�ĪŻ
14.į┌╚▄䮾wĘeę╗Č©Ą─Śl╝■Ž┬Ż¼į§śė╝ė╦┘╣╠¾w╬’┘|(zh©¼)Ą─╚▄ĮŌ?
ę╗░Ń│Żė├Ą─ėąŽ┬├µĄ─╦─ĘNĘĮĘ©��ĪŻ
(l)īó╣╠¾w╚▄┘|(zh©¼)čą─ź│╔╝Ü(x©¼)Ą─Ę█─®��ĪŻ╣╠¾w╚▄┘|(zh©¼)Ą─Ņw┴ŻįĮąĪ����Ż¼╦³Ė·╚▄ä®Įėė|Ą─├µĘeŠ═įĮ┤¾ĪŻŠ═įĮ╚▌ęū╚▄ĮŌ����ĪŻę“┤╦��Ż¼į┌╣╠¾w╚▄┘|(zh©¼)╬┤Ę┼╚ļ╚▄ä®ųąęįŪ░���Ż¼Ž╚īó┤¾Ņw┴ŻĄ─╣╠¾w╚▄┘|(zh©¼)Ę┼į┌čą└Åųąčą─źŻ¼┤²čą│╔╝Ü(x©¼)Ą─Ę█─®ęį║¾����Ż¼į┘Ę┼╚ļ╚▄ä®ų«ųą�����Ż¼▀@śė┐╔╩╣╚▄ĮŌĄ─╦┘┬╩╝ė┐ņ�����ĪŻ
(2)š±╩Ä��ĪŻ╚ń╣¹╩Ūį┌įć╣▄ųą▀M(j©¼n)ąą╔┘┴┐╣╠¾w╚▄┘|(zh©¼)Ą─╚▄ĮŌĢr(sh©¬)�Ż¼┐╔ęįė├š±╩ÄĄ─ĘĮĘ©Ż¼╝ė╦┘╣╠¾w╚▄┘|(zh©¼)Ą─╚▄ĮŌ����ĪŻ
(3)öć░Ķ�ĪŻ╚ń╣¹╩Ūį┌¤²▒Łųą▀M(j©¼n)ąą▌^ČÓ┴┐╣╠¾w╚▄┘|(zh©¼)Ą─╚▄ĮŌĢr(sh©¬)����Ż¼ė├▓Ż┴¦░¶▓╗öÓĄž?c©ói)ć░Ķ╚▄ę║Ż¼┐╔ęį╝ė╦┘╣╠¾w╬’┘|(zh©¼)Ą─╚▄ĮŌ����ĪŻ
(4)╝ė¤ßĪŻ╝ė¤ßĢr(sh©¬)┐╔ęįį÷╝ėĘųūė▀\(y©┤n)äė(d©░ng)Ą─╦┘┬╩��ĪŻ┴Ē═Ō�Ż¼Į^┤¾ČÓöĄ(sh©┤)╣╠¾w╬’┘|(zh©¼)Ą─╚▄ĮŌČ╚╩ŪļSų°£žČ╚Ą─╔²Ė▀Č°į÷┤¾Ą─ĪŻę“┤╦╝ė¤ßĢr(sh©¬)ę▓┐╔ęį╩╣╣╠¾w╬’┘|(zh©¼)╚▄ĮŌČ╚į÷┤¾��Ż¼╚▄ĮŌ╦┘┬╩ę▓╝ė┐ņ┴╦�����ĪŻ
15.╗ņ║Ž╬’ĘųļxĄ─ĘĮĘ©ėą──ÄūĘN?
╗ņ║Ž╬’ĘųļxĄ─ĘĮĘ©ėą▀^×VĘ©����Īóš¶░l(f©Ī)Ę©Īóš¶sĘ©��ĪóĘųę║Ę©ĪóĮY(ji©”)Š¦Ę©Ą╚╬ÕĘN��ĪŻ
16.╩▓├┤ŅÉą═Ą─╗ņ║Ž╬’▓╔ė├▀^×VĘ©Ęųļx?
▀^×V╩Ū░č▓╗╚▄ė┌ę║¾wĄ─╣╠¾w╬’┘|(zh©¼)Ė·ę║¾wĘųļxĢr(sh©¬)▓╔ė├Ą─ę╗ĘNĘĮĘ©����ĪŻ╚ń┤ų¹}Ą─╠ß╝āŻ¼╩ūŽ╚Š═╩Ū░č┤ų¹}╚▄ė┌╦«��Ż¼Įø(j©®ng)▀^▀^×V��Ż¼░č▓╗╚▄ė┌╦«Ą──Ó═┴Ą╚╣╠¾wļs┘|(zh©¼)Ė·╩│¹}╦«Ęųļx�����ĪŻ
17.į§śėčbéõ▀^×VŲ„?
╚ńłD╦∙╩Š����ĪŻ
╚Īę╗ÅłłAą╬×V╝ł(łDA)Ż¼Ž╚š█│╔░ļłA(łDB)Ż¼į┘š█│╔╦─Ą╚Ęų(łDC)�����Ż¼╚╗║¾┤“ķ_╩╣ų«│╔×ķłAÕFą╬���Ż¼░čłAÕFą╬Ą─×V╝ł╝ŌČ╦▓┐ĘųŽ“Ž┬Ż¼Ę┼╚ļ┬®ČĘ└’Ż¼×V╝łĄ─▀ģŠēæ¬(y©®ng)▒╚┬®ČĘ┐┌╔įĄ═�Ż¼╝sĄ═5mmū¾ėęŻ¼░čČÓėÓĄ─×V╝ł╝¶╚ź���ĪŻ╚╗║¾ė├╩ųē║ūĪ×V╝ł���Ż¼ė├╦«ØÖر×V╝łŻ¼╩╣×V╝łŠo┘N┬®ČĘĄ─ā╚(n©©i)▒┌�����Ż¼ųąķg▓╗ę¬┴¶ėąÜŌ┼▌�ĪŻ▀@śėŠ═ū÷│╔ę╗éĆ(g©©)▀^×VŲ„ĪŻ
18.▀^×V▓┘ū„ėą──ą®ę¬ŅI(l©½ng)?
×ķ▒Ńė┌ėøæøŲęŖ�����Ż¼▀^×V▓┘ū„ųąĄ─ę¬ŅI(l©½ng)┐╔Ė┼└©×ķŻ║ę╗ĮŪ����Īóę╗öćĪóę╗ņoų├����ĪóČ■Ą═����Īó╚²Įėė|����ĪŻ
ę╗ĮŪŻ║╩ŪųĖ×V╝łš█»BĢr(sh©¬)Ą─ĮŪČ╚ę¬┼c┬®ČĘĄ─ĮŪČ╚ŽÓę╗ų┬�ĪŻ▀@śė╝¶╠ߥ─×V╝łŻ¼▓┼─▄Šo┘N┬®ČĘĄ─ā╚(n©©i)▒┌��Ż¼▀@śė▓┼─▄▒ŻūC▀^×VĄ─╦┘┬╩┐ņ�ĪŻ(▒▒Š®×ķę╗┘N ×V╝łŠo┘N┬®ČĘā╚(n©©i)▒┌)
ę╗öćŻ║īó╗ņ║Ž╬’Ą╣╚ļ╦«ųąęį║¾Ż¼ė├▓Ż┴¦░¶öć░Ķ����Ż¼┐╔ęį╝ė┐ņŲõųą┐╔╚▄ąį╬’┘|(zh©¼)Ą─╚▄ĮŌ╦┘┬╩ĪŻ
ę╗ņoų├Ż║┤²┐╔╚▄ąį╬’┘|(zh©¼)═Ļ╚½╚▄ĮŌ║¾��Ż¼▓╗ę¬┴ó╝┤Š═▀M(j©¼n)ąą▀^×V�Ż¼ę¬ņoų├Ų¼┐╠ĪŻ─┐Ą─╩Ū╩╣▓╗╚▄ąį╬’┘|(zh©¼)Ą─Ņw┴ŻŽ╚│┴ĄĒ│÷ę╗▓┐Ęų�����Ż¼▀@śėū÷┐╔ęį£p╔┘╗“Ę└ų╣▓╗╚▄ąį╬’┘|(zh©¼)īó×V╝ł╔ŽĄ─╬óąĪ┐ūŽČČ┬╚¹����Ż¼Å─Č°╝ė┐ņ▀^×VĄ─╦┘┬╩��ĪŻ
Č■Ą═Ż║ųĖĄ─╩Ū×V╝łĄ─▀ģŠēę¬╔įĄ═ė┌┬®ČĘĄ─▀ģŠē;į┌š¹éĆ(g©©)▀^×V▀^│╠ųą▀Ćę¬╩╝ĮKūóęŌĄĮ×Vę║Ą─ę║├µę¬Ą═ė┌×V╝łĄ─▀ģŠē����ĪŻĘ±ätĄ─įÆ����Ż¼▒╗▀^×VĄ─ę║¾wĢ■(hu©¼)Å─×V╝ł┼c┬®ČĘų«ķgĄ─ķgŽČ┴„Ž┬�Ż¼ų▒Įė┴„ĄĮ┬®ČĘŽ┬▀ģĄ─Įė╩▄Ų„ųąŻ¼▀@śė╬┤Įø(j©®ng)▀^×VĄ─ę║¾w┼c×Vę║╗ņį┌ę╗Ų��Ż¼Č°╩╣×Vę║£åØß��Ż¼ø]ėą▀_(d©ó)ĄĮ▀^×VĄ──┐Ą─����ĪŻ
╚²Įėė|Ż║ę╗╩ŪųĖ╩óėą┤²▀^×VĄ─ę║¾wĄ╣╚ļ┬®ČĘųąĢr(sh©¬)Ż¼ę¬╩╣╩óėą┤²▀^×Vę║¾wĄ─¤²▒ŁĄ─¤²▒Łūņ┼cāAą▒Ą─▓Ż┴¦░¶ŽÓĮėė|�����ĪŻČ■╩ŪųĖ▓Ż┴¦░¶Ą─Ž┬Č╦ę¬┼c×V╝ł×ķ╚²īėĄ──Ūę╗▀ģŽÓĮėė|ĪŻ╚²╩ŪųĖ┬®ČĘĄ─Ņi▓┐ę¬┼cĮė╩š×Vę║Ą─Įė╩▄Ų„Ą─ā╚(n©©i)▒┌ŽÓĮėė|��ĪŻ
19.ė├▀^×VĘ©╠ß╝ā╬’┘|(zh©¼)Ģr(sh©¬)��Ż¼├┐▓Į▓┘ū„Ą──┐Ą─╩Ū╩▓├┤?
į┌▀^×VĘ©ųą╬Õ▓Į▓┘ū„Ą──┐Ą─Ęųäeöó╩÷╚ńŽ┬Ż║
╚▄ĮŌŻ║╩╣╗ņ║Ž╬’ųąĄ─┐╔╚▄ąį╬’┘|(zh©¼)╚▄ĮŌ���ĪŻ
▀^×VŻ║╩╣╗ņ║Ž╬’ųąĄ─┐╔╚▄ąį╬’┘|(zh©¼)┼c▓╗╚▄ąį╬’┘|(zh©¼)Ęųļx��Ī�Ż┐╔╚▄ąį╬’┘|(zh©¼)į┌×Vę║ųą�����Ż¼▓╗╚▄ąį╬’┘|(zh©¼)┴¶į┌×V╝ł╔Ž����ĪŻŽ┤£ņ│┴ĄĒŻ║╩╣┐╔╚▄ąį╬’┘|(zh©¼)▒M┴┐ū÷ĄĮ╚½▓┐×V│÷ų┴×Vę║ųąĪŻ╩╣┐╔╚▄ąį╬’┘|(zh©¼)┼c▓╗╚▄ąį╬’┘|(zh©¼)ĘųļxĄ─═Ļ╚½�����ĪŻ
š¶░l(f©Ī)Ż║╩╣┐╔╚▄ąį╬’┘|(zh©¼)Å─×Vę║ųą╬÷│÷����ĪŻ
Ž┤£ņŠ¦¾wŻ║ė├╦«(ūŅ║├ė├š¶s╦«)ø_Ž┤Ą¶Š¦¾w▒Ē├µĄ─ļs┘|(zh©¼)Ż¼ęį╩╣╦∙Ą├Ą─Š¦¾w╬’┘|(zh©¼)Ė³╝āā¶�����ĪŻ
20.╩▓├┤ŅÉą═Ą─╗ņ║Ž╬’ė├š¶░l(f©Ī)Ę©Ęųļx?
š¶░l(f©Ī)Ę©╩Ū░č─▄╚▄ė┌╦«Ą─╣╠¾w╬’┘|(zh©¼)Ė·╦«ĘųļxĢr(sh©¬)▓╔ė├Ą─ę╗ĘNĘĮĘ©�����ĪŻ(╚ń┤ų¹}Ą─╠ß╝āīŹ(sh©¬)“×(y©żn)ųą�����Ż¼Įø(j©®ng)▀^×V║¾╦∙Ą├Ą─│╬ŪÕ═Ė├„Ą─╩│¹}╦«Š═╩Ū▓╔ė├š¶░l(f©Ī)Ę©����Ż¼īó╦«š¶░l(f©Ī)Ą¶ęį║¾Ż¼Ą├ĄĮ╝āā¶Ą─╣╠¾w╩│¹}Ą─)���ĪŻ┴Ē═Ō����Ż¼į┘░čŽĪ╚▄ę║ØŌ┐sĢr(sh©¬)�Ż¼▓╔ė├Ą─ę▓╩Ūš¶░l(f©Ī)Ę©����ĪŻų╗╩Ūīó╦«š¶░l(f©Ī)Ą¶ę╗▓┐ĘųČ°╩╣ŽĪ╚▄ę║ūā?y©Łu)ķØŌ╚▄ę║Ą─Ī?/p>
21.╩▓├┤ŅÉą═Ą─╗ņ║Ž╬’ė├š¶sĘ©Ęųļx?
š¶sĘ©╩ŪĘųļx║═╠ß╝ā▒╦┤╦╗źŽÓ─▄ęį╚╬ęŌ▒╚└²╗ź╚▄Ą─ę║¾wĖ·ę║¾wĄ─╗ņ║Ž╬’Ģr(sh©¬)│Żė├Ą─ę╗ĘNĘĮĘ©���ĪŻ╩ŪĖ∙ō■(j©┤)▓╗═¼ę║¾w╬’┘|(zh©¼)Ęą³c(di©Żn)Ė▀Ą═Ą─▓╗═¼���Ż¼īó╦³éāĘųļx╠ß╝āĄ─ę╗ĘNĘĮĘ©ĪŻį┌╝ė¤ßĢr(sh©¬)�����Ż¼Ęą³c(di©Żn)Ą═Ą─ę║¾wŽ╚Ų¹╗»����Ż¼Įø(j©®ng)▀^└õ─²Ų„└õ─²║¾Ż¼Ž╚└õ─²│╔×ķę║¾w�����ĪŻČ°Ęą³c(di©Żn)Ė▀Ą─ę║¾wļyŲ¹╗»����Ż¼ät┴¶į┌š¶s¤²Ų┐ųąĪŻæ¬(y©®ng)ė├▀@ę╗ĘĮĘ©Š═┐╔ęį░č▒╦┤╦╗źŽÓ─▄ęį╚╬║╬▒╚└²╗ź╚▄Ą─ę║¾wĖ·ę║¾wĄ─╗ņ║Ž╬’▀M(j©¼n)ąąĘųļxĪŻ┴Ē═Ō���Ż¼«ö(d©Īng)ę║¾wųą╚▄ĮŌėą─│ĘN╣╠¾w╬’┘|(zh©¼)Ģr(sh©¬)����Ż¼×ķ½@Ą├╝āā¶Ą─ę║¾w���Ż¼Č°░č╚▄ĮŌį┌ŲõųąĄ─╣╠¾w╬’┘|(zh©¼)│²╚źĢr(sh©¬)Ż¼ę▓▓╔ė├š¶sĘ©�ĪŻę“?y©żn)ķ╝ė¤ßĄ─Śl╝■Ž┬Ż¼ę║¾w╩▄¤ßūā│╔š¶Ų¹����Ż¼Å─š¶s¤²Ų┐ųą│÷üĒŻ¼Įø(j©®ng)▀^└õ─²Ų„║¾└õ─²│╔×ķę║¾w��Ż¼▒ŃĄ╬į┌Įė╩▄Ų„ųą�Ż¼įŁüĒ╚▄ĮŌį┌ę║¾wųąĄ─╬’┘|(zh©¼)ät┴¶į┌š¶s¤²Ų┐ųąĪŻųŲ╚Īš¶s╦«Ą╚Š═╩Ūė├š¶sĄ─ĘĮĘ©(╚ńłD╦∙╩Š)���ĪŻ
22.╚ń║╬Öz“×(y©żn)ÜŌ¾w░l(f©Ī)╔·čbų├╩Ūʱ┬®ÜŌ?
į┌īŹ(sh©¬)“×(y©żn)╩ę└’ųŲ╚Īč§ÜŌ��ĪóÜõÜŌ�ĪóČ■č§╗»╠╝Ą╚ÜŌ¾wĢr(sh©¬)Č╝▒žĒÜÖz▓ķčbų├Ą─ÜŌ├▄ąį╩Ūʱ═Ļ║├��Ż¼ų╗ėąčbų├▓╗┬®ÜŌĢr(sh©¬)▓┼─▄╩╣ė├ĪŻ
ę¬Öz▓ķčbų├╩Ūʱ┬®ÜŌ����Ż¼æ¬(y©®ng)░čī¦(d©Żo)ÜŌ╣▄Ą─ę╗Č╦Į■╚ļ¤²▒Ł╗“╦«▓█Ą─╦«ųąŻ¼ė├╩ųŠo╬šįć╣▄╗“ė├╩ųšŲŠo┘N¤²Ų┐Ą─═Ō▒┌�����ĪŻ╚ń╣¹čbų├▓╗┬®ÜŌ�����Ż¼įć╣▄╗“¤²Ų┐└’Ą─┐šÜŌ╩▄¤ß┼“├ø�Ż¼ī¦(d©Żo)╣▄┐┌Š═ėąÜŌ┼▌├░│÷(╚ńłD1╦∙╩Š)ĪŻ
╚╗║¾░č╩ųęŲķ_��Ż¼▀^ę╗Ģ■(hu©¼)ā║���Ż¼┤²įć╣▄╗“¤²Ų┐└õģs║¾����Ż¼╦«Š═Å─¤²▒Ł╗“╦«▓█ųą╔²ĄĮī¦(d©Żo)ÜŌ╣▄└’����Ż¼ą╬│╔ę╗Č╬╦«ų∙��Ż¼ät▒Ē├„čbų├▓╗┬®ÜŌ(╚ńłD2╦∙╩Š)���ĪŻ
╚ń╣¹░l(f©Ī)¼F(xi©żn)čbų├┬®ÜŌŻ¼▒žĒÜšę│÷┬®ÜŌĄ─įŁę“�����Ż¼▓ó▀M(j©¼n)ąąš{(di©żo)š¹����Īóą▐└Ē╗“Ė³ōQ┴Ń╝■�����ĪŻį┘┤╬Öz“×(y©żn)���Ż¼ų▒ų┴čbų├▓╗┬®ÜŌĢr(sh©¬)▓┼─▄▀M(j©¼n)ąąīŹ(sh©¬)“×(y©żn)���ĪŻ

23.īŹ(sh©¬)“×(y©żn)╩ęį§śė╩š╝»Č■č§╗»╠╝?
īŹ(sh©¬)“×(y©żn)╩ęųŲ╚ĪČ■č§╗»╠╝?x©¼)Ō¾w▓╗─▄ė├┼┼╦«╚ĪÜŌĘ©╩š╝»Ż¼ė╔ė┌Č■č§╗»╠╝─▄╚▄ė┌╦«���Ż¼Ą½─▄ē“ė├┼┼┐šÜŌ╚ĪÜŌĘ©╩š╝»�ĪŻė╔ė┌Č■č§╗»╠╝▒╚┐šÜŌųžŻ¼╩š╝»Ģr(sh©¬)╝»ÜŌŲ┐┐┌æ¬(y©®ng)│»╔Ž���Ż¼▓╔ė├Ž“╔Ž┼┼┐šÜŌ╚ĪÜŌĘ©īóČ■č§╗»╠╝╩š╝»į┌╝»ÜŌŲ┐└’���ĪŻė├╚╝ų°Ą─╗▓±Ę┼į┌╝»ÜŌŲ┐┐┌įć“×(y©żn)Ż¼╚ń╣¹╗赎©£ń��Ż¼ätūC├„╝»ÜŌŲ┐└’ęč│õØM┴╦Č■č§╗»╠╝���ĪŻ
24.į§śėÖz“×(y©żn)ę╗č§╗»╠╝╚╝¤²Ą─«a(ch©Żn)╬’?
╚ńłD╦∙╩Š³c(di©Żn)╚╝ę╗č§╗»╠╝���Ż¼╦³┐šÜŌ└’╚╝¤²Ģr(sh©¬)Ą─╗čµ╩Ū╦{(l©ón)╔½Ą─ĪŻę╗č§╗»╠╝╚╝¤²║¾Ą─╔·│╔╬’╩ŪČ■č§╗»╠╝?x©¼)Ō¾w���ĪŻČ■č§╗»╠╝┼c¤²▒Łā╚(n©©i)▒┌│╬ŪÕĄ─╩»╗ę╦«ū„ė├��Ż¼╔·│╔▓╗╚▄ė┌╦«Ą─╠╝╦ßŌ}���Ż¼╩»╗ę╦«ūā£åØßĪŻ
Ę┤æ¬(y©®ng)╚ńŽ┬Ż║
2CO+O2=2CO2
CO2+Ca(OH)2=CaCO3↓+H2O
25.╩▓├┤Įą╬’┘|(zh©¼)Ą─Ķbäe?
ĶbäeŠ═╩ŪĖ∙ō■(j©┤)ÄūĘN▓╗═¼╬’┘|(zh©¼)ąį┘|(zh©¼)Ą─▓╗═¼╝░ėąĻP(gu©Īn)īŹ(sh©¬)“×(y©żn)¼F(xi©żn)Ž¾Ą─▓╗═¼���Ż¼īó╦³éāę╗ę╗ģ^(q©▒)äeķ_�ĪŻ
Įø(j©®ng)│Żė÷ĄĮĄ─╬’┘|(zh©¼)ĶbäeėąÜŌ¾wĶbäe;▀Ćėą╚▄ę║Ą─ĶbäeŻ¼ę▓ĮąļxūėĶbäe��ĪŻ
ÜŌ¾wĄ─Ķbäe╩ŪĖ∙ō■(j©┤)ÜŌ¾w▒Š╔ĒĄ─╠žąįüĒĶbäeĄ─�ĪŻ╚ńė├ĄĮč§ÜŌ─▄ų¦│ų╚╝¤²Ą─ąį┘|(zh©¼)╝░─▄╩╣ĦėąėÓĀaĄ──ŠŚlųžą┬Å═(f©┤)╚╝Ż¼╗“─▄╩╣╚╝ų°Ą──ŠŚlįĮų°įĮ═·Ą─¼F(xi©żn)Ž¾üĒĶbäeč§ÜŌĄ─;ė├ÜõÜŌĄ─┐╔╚╝ąį����ĪóÜõÜŌ╚╝¤²Ģr(sh©¬)Ą─╗čµ╩ŪĄŁ╦{(l©ón)╔½Ą─Ż¼ÜõÜŌ╚╝¤²║¾Ą─«a(ch©Żn)╬’ų╗ėą╦«▀@ę╗ĘN╬’┘|(zh©¼)Ą╚╠žš„üĒĶbäeÜõÜŌ;ė├ę╗č§╗»╠╝Ą─┐╔╚╝ąį�����Īóę╗č§╗»╠╝╚╝¤²Ģr(sh©¬)Ą─╗čµ╩Ū╦{(l©ón)╔½Ą─���Ż¼ę╗č§╗»╠╝╚╝¤²║¾Ą─«a(ch©Żn)╬’╩Ū─▄╩╣│╬ŪÕ╩»╗ę╦«ūā£åĄ─Č■č§╗»╠╝▀@ą®╠žš„üĒĶbäeę╗č§╗»╠╝;ė├ĄĮČ■č§╗»╠╝▓╗ų¦│ų╚╝¤²Ż¼─▄╩╣╚╝ų°Ą──ŠŚlŽ©£ń�Ż¼─▄╩╣│╬ŪÕ╩»╗ę╦«ūā£åĄ╚╠žš„üĒĶbäeČ■č§╗»╠╝?x©¼)Ō¾w;ė├Ą¬?d©▓)Ō▓╗ų¦│ų╚╝¤²Ż¼─▄╩╣╚╝ų°Ą──ŠŚlŽ©£ń��Ż¼Ą½▓╗─▄╩╣│╬ŪÕ╩»╗ę╦«ūā£åĄ╚╠žš„üĒĶbäeĄ¬?d©▓)ŌĪ?/p>
╦ß�����ĪóēA╚▄ę║Ķbäeät╩ŪĖ∙ō■(j©┤)╦ßĪóēAī”ųĖ╩Šä®’@▓╗═¼Ņü╔½üĒĶbäeĄ─�����ĪŻ
Ag+�����ĪóCl-����ĪóSO42-ĪóCO32-Ą╚ļxūėĄ─Ķbäeę▓╩ŪĖ∙ō■(j©┤)▀@ą®ļxūė┼c─│ą®įćä®Ę┤æ¬(y©®ng)Ą─▓╗═¼¼F(xi©żn)Ž¾üĒĶbäeĄ─�����ĪŻĶbäeCl-ė├ĄĮŽ§╦ßŃy║═ŽĪŽ§╦ßā╔ĘNįćä®�����ĪŻĶbäeSO42-ė├ĄĮ┬╚╗»õ^(╗“Ž§╦ßõ^)║═ŽĪŽ§╦ßā╔ĘNįćä®�ĪŻĶbäeCO32-ė├ĄĮÅŖ(qi©óng)╦ß(╚ń¹}╦ß╗“Ž§╦ß)║═╩»╗ę╦«ā╔ĘNįćä®ĪŻĶbäeAg+ė├┐╔╚▄ąįĄ─¹}╦ß¹}╚▄ę║(╗“¹}╦ß)║═ŽĪŽ§╦ßā╔ĘNįćä®�ĪŻ
į┌¹}ŅÉĶbäeĢr(sh©¬)(╚ń╣¹╩ŪĻÄļxūė▓╗═¼Ģr(sh©¬))ĶbäeĒśą“ę╗░Ń╩ŪŽ╚Ķbäe╠╝╦ß¹}Ż¼╚╗║¾į┘Ķbäe┴“╦ß¹}�����Īó¹}╦ß¹}Ż¼«ö(d©Īng)Ųõ╦³╦ßĖ∙ĻÄļxūėČ╝Ķbäe═Ļęį║¾��Ż¼╩ŻėÓĄ─×ķŽ§╦ß¹}�ĪŻ
26.╚ń║╬ė├╗»īW(xu©”)ĘĮĘ©Ķbäeę╗č§╗»╠╝║═Č■č§╗»╠╝
Ė∙ō■(j©┤)ę╗č§╗»╠╝ĪóČ■č§╗»╠╝ā╔ĘNÜŌ¾wąį┘|(zh©¼)Ą─▓╗═¼▀M(j©¼n)ąąĶbäe�����Ż¼ėąęįŽ┬ā╔ĘNĘĮĘ©���ĪŻ
ĘĮĘ©1Ż║╚Īā╔ų¦ØŹā¶Ą─įć╣▄��Ż¼└’▀ģĘųäeĄ╣╚ļ╔┘┴┐│╬ŪÕĄ─╩»╗ę╦«����ĪŻ╚╗║¾īóā╔éĆ(g©©)┘AÜŌŲ┐ųąĄ─ÜŌ¾wĘųäe═©╚ļā╔éĆ(g©©)įć╣▄└’�Ż¼Ųõųąę╗éĆ(g©©)įć╣▄ā╚(n©©i)Ą─╩»╗ę╦«ūā£åØß���Ż¼ūC├„įōÜŌ¾w╩ŪČ■č§╗»╠╝�����Ż¼┴Ēę╗éĆ(g©©)įć╣▄ā╚(n©©i)Ą─╩»╗ę╦«▓╗ūā���Ż¼ätįōÜŌ¾w╩Ūę╗č§╗»╠╝�����ĪŻ
CO2+Ca(OH)2=CaCO3↓+H2O
CO┼cCa(OH)2▓╗Ę┤æ¬(y©®ng)
ĘĮĘ©2Ż║īóā╔éĆ(g©©)┘AÜŌŲ┐ī¦(d©Żo)ÜŌ╣▄Ą─ķyķT(╗Ņ╚¹)┤“ķ_�Ż¼ė├╚╝ų°Ą──ŠŚlĮėĮ³ī¦(d©Żo)ÜŌ╣▄┐┌���ĪŻŲõųąę╗éĆ(g©©)ÜŌ¾w─▄╚╝¤²Ūę░l(f©Ī)│÷╦{(l©ón)╔½╗赥─�����Ż¼ätūC├„įōÜŌ¾w×ķę╗č§╗»╠╝;┴Ēę╗éĆ(g©©)╩╣╚╝ų°Ą──ŠŚlŽ©£ń����Ż¼ät╩ŪČ■č§╗»╠╝�ĪŻ
2CO+O2=2CO2
27.╚ń║╬ĶbäeÜõÜŌĪóę╗č§╗»╠╝�����Īó╝ū═ķ╚²ĘN¤o╔½ÜŌ¾w?
Ęųäe³c(di©Żn)╚╝╚²ĘNÜŌ¾w�Ż¼į┌╚²éĆ(g©©)╗赥─╔ŽĘĮĖ„šųę╗éĆ(g©©)└õČ°Ė╔į’Ą─¤²▒Ł���Ż¼▀^ę╗Ģ■(hu©¼)ā║Ż¼Ģ■(hu©¼)┐┤ĄĮėąā╔éĆ(g©©)¤²▒ŁĄ─ā╚(n©©i)▒┌ūāĄ├─Ż║²▓óėą╦«š¶ÜŌ─²ĮY(ji©”)�����Ż¼ätšf├„▀@ā╔ĘNÜŌ¾wųąėąę╗éĆ(g©©)╩ŪÜõÜŌ����Ż¼┴Ēę╗éĆ(g©©)╩Ū╝ū═ķĪŻį┌¤²▒Łā╚(n©©i)▒┌ø]ėą╦«š¶ÜŌ─²ĮY(ji©”)Ą──ŪĘNÜŌ¾wę╗Č©╩Ūę╗č§╗»╠╝�ĪŻ
į┘Ž“┴Ē═Ōā╔éĆ(g©©)¤²▒Łā╚(n©©i)Ęųäeūó╚ļ╔┘┴┐Ą─│╬ŪÕĄ─╩»╗ę╦«Ż¼š±╩Ä��Ż¼ęŖėą╩»╗ę╦«ūā£åĄ─�����Ż¼ätšf├„─ŪĘNÜŌ¾w×ķ╝ū═ķ�ĪŻ╩»╗ę╦«▓╗ūā£åĄ─Ż¼šf├„─ŪĘNÜŌ¾w×ķÜõÜŌ�ĪŻ
28.ėąč§ÜŌ�����ĪóÜõÜŌĪóĄ¬?d©▓)Ō��Īó┐šÜŌ�Īóę╗č§╗»╠╝ĪóČ■č§╗»╠?ĘNÜŌĪĪ ¾w��Ż¼į§śėĶbäe╦³éā?
╚Ī6ų¦įć╣▄��Ż¼▓óĘųäeĄ╣╚ļ│╬ŪÕĄ─╩»╗ę╦«��ĪŻ╚╗║¾īó6éĆ(g©©)┘A┤µÜŌ¾wĄ─Ž─z┤³╔ŽĄ─ī¦(d©Żo)ÜŌ╣▄Ęųäe▓Õ╚ļ6éĆ(g©©)įć╣▄Ą─╩»╗ę╦«ųą���Ż¼┤“ķ_ūįė╔ŖA���Ż¼ė^▓ņ6éĆ(g©©)įć╣▄ųą╩»╗ę╦«Ą─ūā╗»ĪŻŲõųąėąę╗ų¦įć╣▄ųąĄ─╩»╗ę╦«ūā£åØß���Ż¼┤╦ĘNÜŌ¾w▒ž×ķČ■č§╗»╠╝��ĪŻŲõ╦³╬Õų¦įć╣▄ųą¤oūā╗»�ĪŻĻP(gu©Īn)ķ]ūįė╔ŖA��ĪŻ
╚Īę╗éĆ(g©©)╦«▓█▓óĘ┼║├╦«ĪŻį┘╚Ī5éĆ(g©©)╝»ÜŌŲ┐į┌Ųõā╚(n©©i)▓┐ę▓╚½čbØM╦«▓óĄ╣┴óį┌╦«▓█ųą���ĪŻīó╩ŻėÓĄ─5ĘNÜŌ¾wŠ∙▓╔ė├┼┼╦«╚ĪÜŌĘ©Ė„╩š╝»ę╗╝»ÜŌŲ┐ÜŌ¾w���Ż¼▓óīó┤╦5Ų┐ÜŌ¾wė├▓Ż┴¦Ų¼╔w║├Ż¼Å─╦«▓█ųą╚Ī│÷�����Ż¼Ę┼ų├į┌ū└├µ╔Ž�����ĪŻ
ė├╚╝ų°Ą──ŠŚlĘųäeĘ┼į┌5éĆ(g©©)╝»ÜŌĄ─Ų┐┐┌�Ż¼ė^▓ņ¼F(xi©żn)Ž¾ĪŻ
Ųõųąę╗Ų┐ÜŌ¾w─▄╩╣─ŠŚlįĮų°įĮ═·Ą─�Ż¼ätę╗Č©╩Ūč§ÜŌĪŻ
Ųõųąę╗Ų┐ī”ė┌─ŠŚl╚╝¤²ø]╩▓├┤ė░Ēæ��Ż¼Č°Ų┐ųąÜŌ¾wę▓ø]ėą╚╝¤²¼F(xi©żn)Ž¾Ą─��Ż¼ätę╗Č©╩Ū┐šÜŌ�����ĪŻ
Ųõųąę╗Ų┐─▄╩╣╚╝ų°─ŠŚlŽ©£ńĄ─ę╗Č©×ķĄ¬?d©▓)ŌĪ?/p>
ėąā╔Ų┐ÜŌ¾wį┌ė÷╚╝ų°Ą──ŠŚlĢr(sh©¬)�����Ż¼Ų┐ųąĄ─ÜŌ¾w▒╗³c(di©Żn)╚╝┴╦�Ż¼Ūę╚╝¤²Ģr(sh©¬)Ą─╗赊∙×ķĄŁ╦{(l©ón)╔½Ż¼┤╦Ģr(sh©¬)čĖ╦┘Ąž═∙ā╔éĆ(g©©)╝»ÜŌŲ┐ųąČ╝Ą╣╚ļ╔┘┴┐Ą─│╬ŪÕĄ─╩»╗ę╦«�Ż¼╔w╔Ž▓Ż┴¦Ų¼Ż¼ōuäė(d©░ng)╝»ÜŌŲ┐����Ż¼ė^▓ņ╩»╗ę╦«Ą─ūā╗»ĪŻŲõųąėąę╗Ų┐ųąĄ─╩»╗ę╦«ūā£åØß┴╦���Ż¼ätįŁüĒĄ─ÜŌ¾wę╗Č©×ķę╗č§╗»╠╝����Ż¼ę“?y©żn)ķę╗č§╗»╠╝╚╝¤²║¾╔·│╔Č■č§╗»╠╝�Ż¼Č■č§╗»╠╝╩╣╩»╗ę╦«ūā£åØßĪŻČ°┴Ēę╗╝»ÜŌŲ┐ųąĄ─╩»╗ę╦«ø]ūā╗»�Ż¼ätįŁüĒĄ─ÜŌ¾wę╗Č©×ķÜõÜŌŻ¼ę“?y©żn)ķÜõÜŌ╚╝¤²ų╗─▄╔·│╔╦«Ī?/p>
29.Į±ėą╦«���Īó¹}╦ßĪóÜõč§╗»Ōc╚²Ų┐¤o╔½ę║¾wŻ¼į§śėĶbäe╦³éā?
╚Ī╚²ų¦įć╣▄��Ż¼▓óĘųäeĄ╣╚ļ╬┤ų¬ę║1mLų┴2mL���Ż¼╚╗║¾Ė„Ą╬╚ļ╩»╚’įćę║2Ą╬ų┴3Ą╬�Ż¼š±╩Ä�����Ż¼ė^▓ņ¼F(xi©żn)Ž¾����ĪŻ╩╣╩»╚’įćę║ūā╝tš▀����Ż¼įŁę║¾w×ķ¹}╦ß����ĪŻ╩╣╩»╚’įćę║ūā╦{(l©ón)š▀��Ż¼įŁę║¾w×ķÜõč§╗»Ōc���ĪŻ╩»╚’įćę║▓╗ūā╔½╚į×ķūŽ╔½š▀Ż¼įŁę║¾w×ķ╦«����ĪŻ
30.ė├ę╗ĘNįćä®��Ż¼╚ń║╬īó╠╝╦ßŌø��ĪóŽ§╦ßŃyĪó┴“╦ßõ\╚²ĘN╚▄ę║ģ^(q©▒)äeķ_?
╚Ī╚²ų¦įć╣▄��Ż¼▓óĘųäeĄ╣╚ļ╬┤ų¬ę║1mLų┴2mL�����Ż¼╚╗║¾Ė„Ą╣╚ļ1mLų┴2mL¹}╦߯¼ė^▓ņ¼F(xi©żn)Ž¾����ĪŻ╚¶ę╗éĆ(g©©)įć╣▄ųąėą¤o╔½ÜŌ┼▌Ę┼│÷š▀����Ż¼įŁ╚▄ę║×ķ╠╝╦ßŌø╚▄ę║���ĪŻ
K2CO3+2HCl=2KCl+H2O+CO2↑
╚¶ę╗éĆ(g©©)įć╣▄ųąėą░ū╔½│┴ĄĒ╔·│╔š▀�����Ż¼įŁ╚▄ę║×ķŽ§╦ßŃy╚▄ę║�����ĪŻ
AgNO3+HCl=AgCl↓+HNO3
╚ńę╗éĆ(g©©)įć╣▄ųą╝╚¤oÜŌ┼▌Ę┼│÷ę▓¤o░ū╔½│┴ĄĒ╔·│╔Ż¼ėų¤oŲõ╦³¼F(xi©żn)Ž¾░l(f©Ī)╔·Ą─�Ż¼įŁ╚▄ę║×ķ┴“╦ßõ\╚▄ę║�����ĪŻ
31.Į±ėą┬╚╗»Ōø��ĪóŽ§╦ßŌø��Īó╠╝╦ßŌøĪó┴“╦ßŌø╦─ĘN░ū╔½╣╠¾wĘ█─®��Ż¼į§śėĶbäe╦³éā?
╚Ī┬╚╗»Ōø���ĪóŽ§╦ßŌø��Īó╠╝╦ßŌøĪó┴“╦ßŌø╦─ĘN░ū╔½╣╠¾wĘ█─®Ė„ę╗╦Ä│ū�����Ż¼ĘųäeĘ┼╚ļ╦─éĆ(g©©)¤²▒Łųą���ĪŻį┘į┌Ė„¤²▒Łųą╝ė▀m┴┐š¶s╦«╩╣Ųõ═Ļ╚½╚▄ĮŌ����Ż¼Ą├╦─ĘN¤o╔½╚▄ę║����ĪŻ
╚Ī╦─ų¦įć╣▄ĘųäeĄ╣╚ļ╬┤ų¬ę║1mLų┴2mLŻ¼▓ó═∙╦─ų¦įć╣▄ųą╝ė╚ļ1mLų┴2mL¹}╦ß���ĪŻŲõųąę╗ų¦įć╣▄ųąėą¤o╔½ÜŌ┼▌«a(ch©Żn)╔·Ż¼ätįŁ╬’┘|(zh©¼)×ķ╠╝╦ßŌø���ĪŻ
K2CO3+2HCl=2KCl+H2O+CO2↑
Ųõ╦³╚²ų¦įć╣▄ųąø]ėąÜŌ┼▌╔·│╔Ż¼ę▓¤oŲõ╦³¼F(xi©żn)Ž¾░l(f©Ī)╔·�ĪŻę“┬╚╗»Ōø��ĪóŽ§╦ßŌøĪó┴“╦ßŌø╚²ĘN╚▄ę║Ė·¹}╦ßČ╝▓╗Ę┤æ¬(y©®ng)�ĪŻ
į┘╚Ī╚²ų¦įć╣▄ĘųäeĄ╣╚ļėÓŽ┬Ą─╚²ĘN╬┤ų¬ę║1mLų┴2mL▓ó═∙╚²ų¦įć╣▄ųą╝ė╚ļ1mLų┴2mL┬╚╗»õ^╚▄ę║�����Ż¼Ųõųąę╗éĆ(g©©)ėą░ū╔½│┴ĄĒ╔·│╔����Ż¼į┘Ą╬╚ļ1mLų┴2mLŽĪŽ§╦ß��ĪŻ╚ń╣¹░ū╔½│┴ĄĒ▓╗Ž¹╩¦�Ż¼ät┤╦įŁ╬’┘|(zh©¼)×ķ┴“╦ßŌø��ĪŻ
K2SO4+BaCl2=BaSO4↓+2KCl
Ųõ╦³ā╔ų¦įć╣▄ųąø]ėą░ū╔½│┴ĄĒ╔·│╔Ż¼ę▓¤oäeĄ─¼F(xi©żn)Ž¾░l(f©Ī)╔·�����ĪŻę“?y©żn)ķ┬╚╗»Ōø�����ĪóŽ§╦ßŌøā╔ĘN╚▄ę║Ė·┬╚╗»õ^╚▄ę║Č╝▓╗Ę┤æ¬(y©®ng)ĪŻ
į┘╚Īā╔ų╗įć╣▄ĘųäeĄ╣╚ļėÓŽ┬Ą─ā╔ĘN╬┤ų¬ę║1mLų┴2mL����Ż¼▓ó═∙ā╔ų¦įć╣▄ųą╝ė╚ļ1mLų┴2mLŽ§╦ßŃy╚▄ę║����Ż¼Ųõųąę╗éĆ(g©©)ėą░ū╔½│┴ĄĒ╔·│╔��Ż¼į┘Ą╬╚ļ1mLų┴2mLŽĪŽ§╦ß����Ż¼╚ń╣¹░ū╔½│┴ĄĒ▓╗Ž¹╩¦��Ż¼ät┤╦įŁ╬’┘|(zh©¼)×ķ┬╚╗»Ōø��ĪŻ
KCl+AgNO3=AgCl↓+KNO3
į┌┴Ēę╗įć╣▄ųąø]ėą░ū╔½│┴ĄĒ╔·│╔Ż¼ę▓¤oŲõ╦³¼F(xi©żn)Ž¾░l(f©Ī)╔·��ĪŻę“?y©żn)ķŽ§╦ßŌø╚▄ę║Ė·Ž§╦ßŃy╚▄ę║▓╗Ę┤æ¬(y©®ng)�����ĪŻ
╦∙ęįŻ¼ėÓŽ┬Ą─ę╗ĘNįŁ╬’┘|(zh©¼)×ķŽ§╦ßŌø�����ĪŻ
32.╚ń║╬ĶbČ©ę╗Ų┐¤o╔½ę║¾w×ķ¹}╦ß?
¹}╦ß╚▄ę║ųąĄ─Ļ¢ļxūė×ķÜõļxūė(H+)�����Ż¼ĻÄļxūė×ķ┬╚ļxūė(Cl-)ĪŻ╚ń╣¹═©▀^ę╗Č©Ą─īŹ(sh©¬)“×(y©żn)▓Į¾E║═Š▀¾wĄ─īŹ(sh©¬)“×(y©żn)¼F(xi©żn)Ž¾─▄┤_Č©╚▄ę║ųą╝╚║¼ėąÜõļxūėėų║¼ėą┬╚ļxūė�Ż¼Š═─▄┤_Č©įō¤o╔½╚▄ę║ę╗Č©×ķ¹}╦ß���ĪŻ
Öz“×(y©żn)Üõļxūė(H+)ĪŻ░čā╔ēKõ\┴ŻĘ┼╚ļę╗ų¦įć╣▄ųą�����Ż¼īó╔┘┴┐┤²ĶbČ©Ą─¤o╔½╚▄ę║Ą╣╚ļįć╣▄ųą3mL—5mL����Ż¼ė├─┤ųĖČ┬ūĪįć╣▄┐┌�����Ż¼┤²įć╣▄ųąÜŌ¾wī”─┤ųĖĄ─ē║┴”▌^┤¾Ģr(sh©¬)Ż¼ęŲķ_─┤ųĖ�Ż¼┴ó╝┤ė├╚╝ų°Ą─╗▓±³c(di©Żn)╚╝įć╣▄ųąĄ─ÜŌ¾w���Ż¼╚ń╣¹ÜŌ¾w░▓ņo╚╝¤²╗“░l(f©Ī)│÷╝ŌõJĄ─▒¼°Q┬ĢŻ¼ūC├„ėąÜõÜŌ╔·│╔�Ż¼ę▓Š═ūC├„įŁ¤o╔½╚▄ę║ųą║¼ėąÜõļxūė(H+)ĪŻ
╗“ė├Ė╔į’ŪÕØŹĄ─▓Ż┴¦░¶š║╚Ī┤²£y¤o╔½╚▄ę║Ą╬į┌╦{(l©ón)╔½Ą─╩»╚’įć╝ł╔Ž��Ż¼╚¶╦{(l©ón)╔½╩»╚’įć╝łūā╝t��Ż¼ätūC├„╚▄ę║ųąÜõļxūė(H+)Ą─┤µį┌ĪŻ
Öz“×(y©żn)┬╚ļxūė(Cl-)��ĪŻ╚Īę╗ų¦įć╣▄����Ż¼Ą╣╚ļ┤²£y╚▄ę║1mLų┴2mL╚╗║¾╝ė╚ļ1mLų┴2mLŽ§╦ßŃy╚▄ę║����Ż¼š±╩Ä�Ż¼ė^▓ņ¼F(xi©żn)Ž¾ĪŻ╚ń╣¹ėą░ū╔½│┴ĄĒ╔·│╔�Ż¼į┘╝ė╚ļ1mLų┴2mLŽĪŽ§╦ß��Ż¼╚¶│┴ĄĒ▓╗Ž¹╩¦����Ż¼ätūC├„┬╚ļxūė(Cl-)Ą─┤µį┌��ĪŻ
įō¤o╔½╚▄ę║ųą╝╚║¼ėąÜõļxūėėų║¼ėą┬╚ļxūė����Ż¼ät┤╦╚▄ę║×ķ¹}╦ß���ĪŻ
33.╚ń║╬Öz“×(y©żn)H+��ĪóAg+����ĪóOH-ĪóCl-�����ĪóSO42-���ĪóCO32-┴∙ĘNļxūė?
(1)H+Öz“×(y©żn)����ĪŻ
ĘĮĘ©1īóūŽ╔½╩»╚’įćę║Ą╬╚ļ╩óėą╔┘┴┐┤²£yę║Ą─įć╣▄ųą��Ż¼š±╩Ä���Ż¼╚ń╣¹╩»╚’įćę║ūā╝t�����Ż¼ätūC├„H+┤µį┌�ĪŻ
ĘĮĘ©2ė├Ė╔į’ŪÕØŹĄ─▓Ż┴¦░¶š║╚Ī╬┤ų¬ę║Ą╬į┌╦{(l©ón)╔½╩»╚’įć╝ł╔Ž�����Ż¼╚ń╣¹╦{(l©ón)╔½įć╝łūā╝t�Ż¼ätūC├„H+Ą─┤µį┌�����ĪŻ
ĘĮĘ©3ė├Ė╔į’ŪÕØŹĄ─▓Ż┴¦░¶š║╚Ī╬┤ų¬ę║Ą╬į┌pHįć╝ł╔ŽŻ¼╚╗║¾░čįć╝ł’@╩ŠĄ─Ņü╔½Ė·ś╦(bi©Īo)£╩(zh©│n)▒╚╔½┐©ī”šš��Ż¼▒Ń┐╔ų¬Ą└╚▄ę║Ą─pH��Ż¼╚ń╣¹pHąĪė┌7Ż¼ätūC├„H+Ą─┤µį┌�����ĪŻ
(2)Ag+Öz“×(y©żn)ĪŻ
īó╔┘┴┐¹}╦ß╗“╔┘┴┐┐╔╚▄ąįĄ─¹}╦ß¹}╚▄ę║Ą╣╚ļ╩óėą╔┘┴┐┤²£yę║Ą─įć╣▄ųą�Ż¼š±╩Ä�����Ż¼╚ń╣¹ėą░ū╔½│┴ĄĒ╔·│╔�Ż¼į┘╝ė╚ļ╔┘┴┐Ą─ŽĪŽ§╦ß�Ż¼╚ń╣¹│┴ĄĒ▓╗Ž¹╩¦�Ż¼ätūC├„Ag+Ą─┤µį┌�����ĪŻ
(3)OH-Ą─Öz“×(y©żn)ĪŻ
ĘĮĘ©1īóūŽ╔½╩»╚’įćę║Ą╬╚ļ╩óėą╔┘┴┐┤²£yę║Ą─įć╣▄ųą����Ż¼š±╩Ä��Ż¼╚ń╣¹╩»╚’įćę║ūā╦{(l©ón)Ż¼ätūC├„OH-Ą─┤µį┌��ĪŻ
ĘĮĘ©2ė├Ė╔į’ŪÕØŹĄ─▓Ż┴¦░¶š║╚Ī╬┤ų¬ę║Ą╬į┌╝t╔½╩»╚’įć╝ł╔Ž�����Ż¼╚ń╣¹╝t╔½╩»╚’įć╝łūā╦{(l©ón)����Ż¼ätūC├„OH-Ą─┤µį┌�����ĪŻ
ĘĮĘ©3īó¤o╔½Ą─Ęė╠¬įćę║Ą╬╚ļ╩óėą╔┘┴┐┤²£yę║Ą─įć╣▄ųąŻ¼š±╩Ä�Ż¼╚ń╣¹Ęė╠¬įćę║ūā╝t����Ż¼ätūC├„OH-Ą─┤µį┌�����ĪŻ
ĘĮĘ©4ė├Ė╔į’ŪÕØŹĄ─▓Ż┴¦░¶š║╚Ī╬┤ų¬ę║Ą╬į┌pHįć╝ł╔ŽŻ¼╚╗║¾░čįć╝ł’@╩ŠĄ─Ņü╔½Ė·ś╦(bi©Īo)£╩(zh©│n)▒╚╔½┐©ī”šš���Ż¼▒Ń┐╔ų¬Ą└╚▄ę║Ą─pH�����Ż¼╚ń╣¹pH┤¾ė┌7Ż¼ätūC├„OH-Ą─┤µį┌ĪŻ
(4)Cl-Ą─Öz“×(y©żn)��ĪŻ
īó╔┘┴┐Ą─Ž§╦ßŃy╚▄ę║Ą╣╚ļ╩óėą╔┘┴┐┤²£yę║Ą─įć╣▄ųą���Ż¼š±╩Ä����Ż¼╚ń╣¹ėą░ū╔½│┴ĄĒ╔·│╔���Ż¼į┘╝ė╚ļ╔┘┴┐Ą─ŽĪŽ§╦߯¼╚ń╣¹│┴ĄĒ▓╗Ž¹╩¦��Ż¼ätūC├„Cl-Ą─┤µį┌��ĪŻ
(5)SO42-Ą─Öz“×(y©żn)�ĪŻ
īó╔┘┴┐┬╚╗»õ^╚▄ę║╗“Ž§╦ßõ^╚▄ę║Ą╣╚ļ╩óėą╔┘┴┐┤²£yę║Ą─įć╣▄ųą���Ż¼š±╩Ä��Ż¼╚ń╣¹ėą░ū╔½│┴ĄĒ╔·│╔�����Ż¼į┘╝ė╚ļ╔┘┴┐Ą─ŽĪŽ§╦߯¼╚ń╣¹│┴ĄĒ▓╗Ž¹╩¦��Ż¼ätūC├„SO42-Ą─┤µį┌���ĪŻ
(6)CO32-Ą─Öz“×(y©żn)�����ĪŻ
īó╔┘┴┐Ą─¹}╦ß╗“Ž§╦ߥ╣╚ļ╩óėą╔┘┴┐┤²£yę║Ą─įć╣▄ųą�����Ż¼╚ń╣¹ėą¤o╔½ÜŌ¾wĘ┼│÷Ż¼īó┤╦ÜŌ¾w═©╚ļ╩óėą╔┘┴┐│╬ŪÕ╩»╗ę╦«Ą─įć╣▄ųą�Ż¼╚ń╣¹╩»╗ę╦«ūā£å���Ż¼ätūC├„įŁ┤²£yę║ųąCO32-Ą─┤µį┌ĪŻ
34.ę╗ĮMėąĻP(gu©Īn)═ą▒P╠ņŲĮĄ─▀xō±Ņ}╬÷
═ą▒P╠ņŲĮį┌│§ųą╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)ųąš╝ėąųžę¬╬╗ų├�Ż¼ęį┤╦×ķ─┐Ą─įO(sh©©)ėŗ(j©¼)ę╗ą®▀xō±Ņ}üĒ┐╝▓ņīW(xu©”)╔·╩Ūʱ▀_(d©ó)ĄĮæ¬(y©®ng)ų¬Ģ■(hu©¼)ė├Ą─ś╦(bi©Īo)£╩(zh©│n)╝░╚ń║╬ė├ŲĮ║ŌĄ─ė^³c(di©Żn)üĒĘų╬÷╠ņŲĮ╔ŽĄ─╗»īW(xu©”)Ę┤æ¬(y©®ng)��Ż¼▀@ī”┼ÓB(y©Żng)īW(xu©”)╔·Ęų╬÷å¢Ņ}║═ĮŌøQå¢Ņ}Ą──▄┴”Ż¼Š▀ėą║▄Ė▀Ą─īŹ(sh©¬)ė├ār(ji©ż)ųĄ�ĪŻ
ę╗��Īó═ą▒P╠ņŲĮ╩╣ė├Ą─╗∙ĄA(ch©│)ų¬ūR(sh©¬)
└²1Ż║į┌╩╣ė├═ą▒P╠ņŲĮŪ░Ż¼ųĖßśŲ½Ž“ėę▀ģ���Ż¼ę¬╩╣╠ņŲĮųĖßśųĖį┌┴Ń³c(di©Żn)Īó─Ū├┤æ¬(y©®ng)īó(ĪĪĪĪ )
A.ū¾Č╦Ą─┬▌ĮzŽ“═Ōš{(di©żo)╣Ø(ji©”)
B.ėęČ╦Ą─┬▌ĮzŽ“═Ōš{(di©żo)╣Ø(ji©”)
C.ū¾Č╦Ą─┬▌ĮzŽ“└’š{(di©żo)╣Ø(ji©”)
D.ėęČ╦Ą─┬▌ĮzŽ“└’š{(di©żo)╣Ø(ji©”)
Ęų╬÷Ż║═ą▒P╠ņŲĮ╩ŪĖ∙ō■(j©┤)Ė▄ŚUįŁ└ĒųŲ│╔Ą─Ż¼ųĖßśŲ½Ž“ėę▀ģ���Ż¼šf├„ėę▒PĄ─┘|(zh©¼)┴┐Ė▀���ĪŻę“┤╦Ż¼š{(di©żo)╣Ø(ji©”)┬▌ĮzĄ─ĘĮĘ©ėąā╔ĘNŻ║ó┘╣╠Č©ū¾Č╦┬▌Įz�Ż¼░čėęČ╦Ą─┬▌ĮzŽ“└’š{(di©żo)�����ĪŻó┌╣╠Č©ėęČ╦┬▌Įz��Ż¼īóū¾Č╦Ą─┬▌ĮzŽ“═Ōš{(di©żo)╣Ø(ji©”)����ĪŻ’@╚╗�����Ż¼┤╦Ņ}æ¬(y©®ng)▀xō±A�ĪóD���ĪŻ
Č■����Īó╬’����Īó┤a╬╗ų├ŅŹĄ╣ī”īŹ(sh©¬)“×(y©żn)öĄ(sh©┤)ō■(j©┤)Ą─ė░Ēæ
└²2Ż║ė├═ą▒P╠ņŲĮĘQ┴┐Ģr(sh©¬)��Ż¼ėą═¼īW(xu©”)īóĒ└┤a┼cĘQ┴┐╬’Ą─╬╗ų├ŅŹĄ╣┴╦�Ż¼ū¾▒P╦∙╝ėĒ└┤a×ķ6gŻ¼ė╬┤aęŲĄĮ┐╠Č╚│▀╔Ž0.4g╠Ä▀_(d©ó)ĄĮŲĮ║Ō�����Ż¼ätĘQ┴┐╬’Ą─īŹ(sh©¬)ļH┘|(zh©¼)┴┐╩ŪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪ(ĪĪĪĪ )
A.6.4g;ĪĪ B.6g;ĪĪ C.5.6g;ĪĪ D.5.4g
╬÷ĮŌŻ║═ą▒P╠ņŲĮŲĮ║Ō▒žĒÜØMūŃŽ┬┴ąĻP(gu©Īn)ŽĄŻ║ū¾▒P▒╗ĘQ╬’┘|(zh©¼)┘|(zh©¼)┴┐=ėę▒PĒ└┤a┘|(zh©¼)┴┐+ė╬┤a┘|(zh©¼)┴┐ĪŻ«ö(d©Īng)Ē└┤a║═ĘQ┴┐╬’╬╗ų├ŅŹĄ╣Ģr(sh©¬)�����Ż¼ätėąmĘQ┴┐╬’+0.4=6��Ż¼’@╚╗┤░Ė×ķC�����ĪŻ
╚²��Īó╠ņŲĮ╔Ž╗»īW(xu©”)Ę┤æ¬(y©®ng)ī”ŲõŲĮ║ŌĄ─ė░Ēæ
└²3Ż║ėąę╗═ą▒P╠ņŲĮŻ¼ū¾ėęā╔▒PĄ─¤²▒ŁųąŠ∙ä“╩óėą┘|(zh©¼)┴┐�ĪóØŌČ╚ŽÓ═¼Ą─ūŃ┴┐ŽĪ┴“╦ß╠ņŲĮŲĮ║Ō���Ż¼═∙ū¾ėęā╔éĆ(g©©)¤²▒ŁųąĘųäe╝ė╚ļ1gFeĘ█║═ZnĘ█�Ż¼ųĖßśūŅĮKĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪĪ (ĪĪĪĪ )
A.Ų½ū¾ĪĪĪĪĪĪB.Ų½ėę
C.▓╗Ų½▐D(zhu©Żn)ĪĪ D.¤oĘ©┼ąöÓ
Ęų╬÷Ż║ĶF║═õ\Ė·ūŃ┴┐ŽĪ┴“╦ßĘ┤æ¬(y©®ng)�����Ż¼Š∙╔·│╔+2ār(ji©ż)Ą─ļxūė��Ż¼ė╔ė┌ĶFĄ─ŽÓī”įŁūė┘|(zh©¼)┴┐▒╚õ\ąĪŻ¼į┌┘|(zh©¼)┴┐ŽÓ═¼Ą─ŪķørŽ┬���Ż¼ų├ōQ│÷╚źĄ─ÜõÜŌČÓŻ¼ę“Č°ū¾▀ģ¤²▒ŁųąĄ─╚▄ę║┘|(zh©¼)┴┐▌^ąĪ���Ż¼ųĖßśŽ“ėęŲ½��ĪŻ┤░Ė×ķBĪŻ
└²4Ż║į┌A��ĪóBā╔¤²▒Łųą�Ż¼Ęųäe╩óėąĄ╚┘|(zh©¼)┴┐Ą╚ØŌČ╚Ą─ūŃ┴┐┴“╦ß�����Ż¼░čAĪóBā╔¤²▒ŁĘ┼į┌╠ņŲĮū¾ėęā╔▒Pųą�����Ż¼╠ņŲĮŲĮ║Ō�����ĪŻ╚¶į┌A¤²▒Łųą╝ė╚ļ4.4gCuOŻ¼─Ū├┤į┌B¤²▒Łųą╝ė╚ļČÓ╔┘┐╦µVŚl����Ż¼╠ņŲĮį┘┤╬▀_(d©ó)ĄĮŲĮ║Ō
(ĪĪĪĪ )
A.4.4gĪĪ B.4.8gĪĪ C.8.8gĪĪ D.9.6g
╬÷ĮŌŻ║A¤²▒Łųą╝ė╚ļĄ─4.4gCuO┼c┴“╦ßĘ┤æ¬(y©®ng)║¾����Ż¼¤oÜŌ¾wĘ┼│÷��Ż¼ā¶į÷┘|(zh©¼)┴┐4.4gĪóį┌B¤²▒Łųą╝ė╚ļĄ─Mg┼c┴“╦ßĘ┤æ¬(y©®ng)Ę┼│÷H2���Ż¼ų╗ėąB¤²▒Łųą╝ė╚ļMgĄ─┘|(zh©¼)┴┐┼cĘ┼│÷H2┘|(zh©¼)┴┐ų«▓ŅĄ╚ė┌4.4g�����Ż¼╠ņŲĮ▓┼─▄▀_(d©ó)ĄĮŲĮ║Ō���ĪŻ
įO(sh©©)B¤²▒Łųą╝ė╚ļMgx┐╦
Mg+H2SO4=MgSO4+H2↑ĪĪ m
24 2ĪĪ 22
xgĪĪ 4.4g
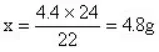
┤░Ėæ¬(y©®ng)×ķB
35.╗»īW(xu©”)īŹ(sh©¬)“×(y©żn)ė├šZ▒µ╬÷
1.“╚▄╗»”┼c“╚█╗»”
“╚▄╗»”╩ŪųĖ╣╠¾wį┌╦«(╗“Ųõ╦³ę║¾w)ųą╚▄ĮŌ��ĪŻ╚ńšß╠Ūį┌╦«ųą╚▄╗»┴╦Ż¼ĄŌį┌ŠŲŠ½ųą╚▄╗»┴╦�ĪŻ
“╚█╗»”╩ŪųĖ╣╠¾w╝ė¤ßĄĮę╗Č©│╠Č╚ūā│╔┴╦ę║æB(t©żi)�����ĪŻ╚ńĶF╝ė¤ßĄĮ1535ĪµĢr(sh©¬)╚█╗»│╔ĶF╦«����Ż¼┴“╝ė¤ßĄĮ112.8ĪµĢr(sh©¬)╝┤ūā│╔ę║æB(t©żi)┴“��ĪŻ
2.“š¶░l(f©Ī)”┼c“š¶s”
“š¶░l(f©Ī)”╩Ūį┌╝ė¤ßŚl╝■Ž┬╚▄ę║└’╚▄ä®ÜŌ╗»Ą─▀^│╠����ĪŻ╦³─▄╩╣╚▄ę║ØŌ┐s╗“╚▄┘|(zh©¼)ęįŠ¦¾w╬÷│÷�ĪŻš¶░l(f©Ī)ę╗░Ńį┌š¶░l(f©Ī)├¾ųą▀M(j©¼n)ąą���ĪŻ╚ń┬╚╗»Ōc╚▄ę║Įø(j©®ng)š¶░l(f©Ī)║¾┐╔Ą├NaClŠ¦¾w�����ĪŻ
“š¶s”╩Ū└¹ė├ę║¾w╗ņ║Ž╬’Ė„ĮMĘųĄ─Ęą³c(di©Żn)▓╗═¼�Ż¼╩╣ę║¾wÜŌ╗»Č°▀M(j©¼n)ąąĄ─Ęųļx▓┘ū„���Ż¼╦³╩ŪĘųļx╗“╠ß╝āę║æB(t©żi)╗ņ║Ž╬’Ą─│Żė├ĘĮĘ©ĪŻš¶sę╗░Ńį┌š¶s¤²Ų┐ųą▀M(j©¼n)ąą��ĪŻ╚ńš¶s╦«Š═╩Ūė├š¶sĘĮĘ©ųŲ╚ĪĄ─ĪŻ
3.“═©╚ļ”┼c“▓Õ╚ļ”
“═©╚ļ”ę╗░ŃųĖ─│ÜŌ¾w═©▀^ī¦(d©Żo)╣▄▀M(j©¼n)╚ļ─│ĘN╚▄ę║└’����ĪŻ└²╚ń░čCO2ÜŌ¾w═©╚ļĄĮ╩»╗ę╦«ųą���ĪŻ
“▓Õ╚ļ”ę╗░ŃųĖ─│ĘN▓Ż┴¦āxŲ„Ę┼▀M(j©¼n)┴Ēę╗ĘNāxŲ„ųą╗“─│ę║¾wā╚(n©©i)���ĪŻ╚ń░č▓Ż┴¦╣▄▓Õ╚ļŽŲż╚¹ųąŻ¼ėų╚ńį┌ųŲCO2īŹ(sh©¬)“×(y©żn)ųą��Ż¼×ķ┴╦Ę└ų╣ÜŌ¾wÅ─ķLŅi┬®ČĘę▌│÷Ż¼ąĶīó┬®ČĘŽ┬Č╦▓Õ╚ļę║├µęįŽ┬���ĪŻ
4.“Ķbäe”┼c“ĶbČ©”
“Ķbäe”╩ŪĖ∙ō■(j©┤)╬’┘|(zh©¼)Ą─╠žš„īóÄūĘN╬’┘|(zh©¼)ģ^(q©▒)Ęų�����Īó▒µäe│÷üĒ����ĪŻ╚ńĶbäeNaCl║═Na2SO4╚▄ę║�Ż¼┐╔ė├Ą╬╚ļBaCl2╚▄ę║Ą─ĘĮĘ©�Ż¼«a(ch©Żn)╔·░ū╔½│┴ĄĒĄ─įŁ╚▄ę║×ķNa2SO4╚▄ę║�����Ż¼¤oūā╗»Ą─įŁ╚▄ę║×ķNaCl╚▄ę║�ĪŻ
“ĶbČ©”╩Ūę¬┤_Č©─│╬’┘|(zh©¼)Ą─ĮM│╔╗“╩Ūʱ┤µį┌����ĪŻ└²╚ńŻ¼ĶbČ©─│░ū╔½Š¦¾w╩ŪʱNH4Cl�Ż¼Š═ąĶūC├„įō░ū╔½Š¦¾wųą╝╚║¼ėąNH4+����Ż¼ėų║¼ėąCl-����ĪŻ
ėų╚ń�����Ż¼ė├Ą╬╝ė¹}╦ߥ─ĘĮĘ©┐╔ĶbČ©╔·╩»╗ęųą╩Ūʱ║¼ėą╩»╗ę╩»ĪŻ
Š┼�����Īó│ŻęŖīŹ(sh©¬)“×(y©żn)āxŲ„Ą─ė├═Šė├Ę©
36.įć╣▄
ų„ę¬ė├═Š
ó┘ė├ū„╔┘┴┐įć䮥─Ę┤æ¬(y©®ng)╚▌Ų„
ó┌čbų├ąĪą═ÜŌ¾w░l(f©Ī)╔·Ų„
ó█╩š╝»╔┘┴┐ÜŌ¾w
╩╣ė├Ģr(sh©¬)ūóęŌ╩┬ĒŚ(xi©żng)
ó┘┐╔ęį╝ė¤ß,╝ė¤ßĢr(sh©¬)ę¬╩╣ė├įć╣▄ŖA,ŖA│ųįć╣▄Ą─ųą╔Ž▓┐
ó┌╝ė¤ßę║¾w,ę║¾w▓╗Ą├│¼▀^įć╣▄╚▌ĘeĄ─1/3
ó█╝ė¤ß║¾▓╗─▄¾E└õ
37.═ą▒P╠ņŲĮ
═ą▒P╠ņŲĮ╩ŪīŹ(sh©¬)“×(y©żn)╩ę└’ė├ė┌ĘQ┴┐╬’┘|(zh©¼)┘|(zh©¼)┴┐Ą─āxŲ„�ĪŻ├┐ę╗┼_(t©ói)╠ņŲĮČ╝ėą┼cŲõŽÓ┼õ╠ūĄ─Ē└┤a║ąŻ¼Ē└┤a┘|(zh©¼)┴┐ūŅąĪĄ─×ķ1g�����Ż¼ąĪė┌1g┘|(zh©¼)┴┐Ą─╩ŪŲ¼┤a�Ż¼ėą100mgĪó200mg�Īó500mgĄ╚ČÓĘNĪŻę▓ėąĄ─═ą▒P╠ņŲĮų╗ėą5gęį╔ŽĄ─Ē└┤a���Ż¼ĘQ┴┐5gęįŽ┬┘|(zh©¼)┴┐Ģr(sh©¬)�Ż¼╩Ūė├ęŲäė(d©░ng)ė╬┤aĄ─▐kĘ©ĪŻ╩╣ė├═ą▒P╠ņŲĮĘQ┴┐╬’┘|(zh©¼)Ū░�Ż¼ėąė╬┤aĄ─═ą▒P╠ņŲĮæ¬(y©®ng)Ž╚░čė╬┤aĘ┼į┌┐╠Č╚│▀Ą─┴Ń╠Ä�����Ż¼╚╗║¾Öz▓ķ╠ņŲĮĄ─ö[äė(d©░ng)╩Ūʱ▀_(d©ó)ĄĮŲĮ║Ō���ĪŻ╚ń╣¹╠ņŲĮ▀_(d©ó)ĄĮŲĮ║ŌŻ¼ņoų╣Ģr(sh©¬)ųĖßśųĖį┌┐╠Č╚│▀Ą─ųąķg(┴Ń╠Ä)��Ż¼ö[äė(d©░ng)Ģr(sh©¬)į┌┐╠Č╚│▀ū¾ėęā╔▀ģö[äė(d©░ng)Ą─Ė±öĄ(sh©┤)ĮėĮ³ŽÓĄ╚����ĪŻ╚ń╣¹╠ņŲĮ╬┤▀_(d©ó)ŲĮ║ŌŻ¼┐╔ęįš{(di©żo)╣Ø(ji©”)ū¾ėę═ą▒PŽ┬Ą─┬▌─Ė���Ż¼╩╣ö[äė(d©░ng)Ģr(sh©¬)▀_(d©ó)ŲĮ║Ō�����ĪŻĘQ┴┐Ģr(sh©¬)��Ż¼▒╗ĘQ╬’ŲĘĘ┼į┌ū¾▒P╔Ž����Ż¼Ē└┤aĘ┼į┌ėę▒PŻ¼Ž╚╝ė┘|(zh©¼)┴┐┤¾Ą─Ē└┤a�����Ż¼║¾╝ė┘|(zh©¼)┴┐ąĪĄ─Ē└┤a����Ż¼ūŅ║¾╝ėŲ¼┤a(ęŲäė(d©░ng)ė╬┤a)ĪŻ╚Īė├Ē└┤aæ¬(y©®ng)╩╣ė├Ķćūė�ĪŻ╚¶ĘQ┴┐ųĖČ©┘|(zh©¼)┴┐Ą─╬’┘|(zh©¼)Ģr(sh©¬)����Ż¼æ¬(y©®ng)Ž╚īóįō┘|(zh©¼)┴┐Ą─Ē└┤a║═Ų¼┤a(╗“ė╬┤a)Ę┼į┌ėę▒P╔Ž��Ż¼╚╗║¾═∙ū¾▒P╔Ž╝ė▒╗ĘQ╬’┘|(zh©¼)Ż¼«ö(d©Īng)▒╗ĘQ╬’┘|(zh©¼)Ą─┘|(zh©¼)┴┐ĮėĮ³╦∙ąĶ┘|(zh©¼)┴┐Ģr(sh©¬)�����Ż¼┐╔ū¾╩ų─├╦Ä│ū�Ż¼ėę╩ų▐D(zhu©Żn)┼─ū¾╩ų���Ż¼ė├š±äė(d©░ng)╦Ä│ūĄ─ĘĮĘ©╩╣╔┘┴┐╬’┘|(zh©¼)╔ó┬õŽ┬üĒų┴╠ņŲĮŲĮ║Ō���ĪŻ×ķĘ└ų╣╗»īW(xu©”)╦ÄŲĘī”═ą▒PĄ─Ė»╬g║═╬█╚ŠŻ¼╦ÄŲĘ▓╗─▄ų▒ĮėĘ┼į┌═ą▒P╔ŽĘQ┴┐����Ż¼┐╔Ę┼╚ļ¤²▒Ł����Īóš¶░l(f©Ī)├¾║═▒Ē├µ├¾Ą╚╚▌Ų„ųą���ĪŻę▓┐╔╩╣ė├╝łŲ¼Ż¼ĘQ┴┐Ū░į┌ā╔éĆ(g©©)═ą▒P╔ŽĖ„Ę┼ę╗Åł┘|(zh©¼)┴┐ŽÓĮ³Ą─ØŹā¶╝łŲ¼���ĪŻĘQ┴┐║¾ę¬╝░Ģr(sh©¬)ėøõø▒╗ĘQ╬’Ą─┘|(zh©¼)┴┐��ĪŻĘQ┴┐═Ļ«ģ����Ż¼æ¬(y©®ng)░čĒ└┤a║═ĶćūėĘ┼╗žĒ└┤a║ą���Ż¼░čė╬Ē└ęŲ╗ž┴Ń╠ÄĪŻ
38.ŠŲŠ½¤¶
ų„ę¬ė├═Š
īŹ(sh©¬)“×(y©żn)╩ę│Żė├Ą─╝ė¤ßāxŲ„
╩╣ė├Ģr(sh©¬)ūóęŌ╩┬ĒŚ(xi©żng)
ó┘ŠŲŠ½▓╗─▄│¼▀^ŠŲŠ½¤¶╚▌ĘeĄ─2/3
ó┌Į¹ų╣Ž“╚╝ų°Ą─ŠŲŠ½¤¶╠Ē╝ėŠŲŠ½
ó█Į¹ų╣ė├╚╝ų°Ą─ŠŲŠ½¤¶ę²╚╝┴Ēę╗ų╗ŠŲŠ½¤¶
ó▄ė├«ģ,æ¬(y©®ng)ė├¤¶├▒╔w£ń
ó▌æ¬(y©®ng)ė├═Ōčµ▓┐Ęų▀M(j©¼n)ąą╝ė¤ß
39.ķLŅi┬®ČĘ
ų„ę¬ė├═Š
ė├ė┌čb┼õĘ┤æ¬(y©®ng)Ų„���Ż¼▒Ńė┌ūó╚ļę║¾wŻ¼ėąĘ└ų╣ÜŌ¾wę▌│÷Ą─╣”─▄ĪŻ

╩╣ė├Ģr(sh©¬)ūóęŌ╩┬ĒŚ(xi©żng)
ķLŅi┬®ČĘį┌ĮMčbÜŌ¾w░l(f©Ī)╔·čbų├Ģr(sh©¬)����Ż¼æ¬(y©®ng)╩╣ķL╣▄─®Č╦▓Õ╚ļĘ┤æ¬(y©®ng)Ų„ā╚(n©©i)Ą─ę║¾w└’Ż¼Ę└ų╣ÜŌ¾w═©▀^┬®ČĘę▌│÷ĪŻ
40.▓Ż┴¦░¶
ų„ę¬ė├═Š
1.öć░Ķ╚▄ę║Ä═ų·╣╠¾w╬’┘|(zh©¼)Ą─╚▄ĮŌ
2.▀^×VĢr(sh©¬)ę²┴„ę║¾w
3.š¶░l(f©Ī)Ģr(sh©¬)öć░Ķę║¾wĘ└ų╣Šų▓┐▀^¤ßČ°’w×R
4.š║╚Ī╔┘┴┐ę║¾w

╩╣ė├Ģr(sh©¬)ūóęŌ╩┬ĒŚ(xi©żng)
1.öć░ĶĢr(sh©¬)▓╗┐╔ė├┴”▀^├═Ż¼╬┼÷ō¶Ų„▒┌��Ż¼ęįĘ└ų╣ŲŲ┴č�ĪŻ
2.ūóęŌļSĢr(sh©¬)Ž┤£ņŻ¼ęįĘ└╬█╚Š��ĪŻ
3.▓╗┐╔īóĮ■ę║Ą─░¶Č╦Ę┼į┌ū└├µ╔Ž�ĪŻ
╩«Īó╗∙▒ŠīŹ(sh©¬)“×(y©żn)▓┘ū„
41.ė├┴┐═▓┴┐╚Īę║¾wįćä®
╩╣ė├┴┐═▓┴┐ę║Ģr(sh©¬)��Ż¼æ¬(y©®ng)░č┴┐═▓Ę┼į┌╦«ŲĮĄ─ū└├µ╔Ž�����Ż¼╩╣č█Ą─ęĢŠĆ║═ę║¾w░╝ę║├µĄ─ūŅĄ═³c(di©Żn)į┌═¼ę╗╦«ŲĮ├µ╔Ž���Ż¼ūx╚Ī║═░╝├µŽÓŪąĄ─┐╠Č╚╝┤┐╔���ĪŻ▓╗┐╔ė├╩ų┼eŲ┴┐═▓┐┤┐╠Č╚ĪŻ┴┐╚ĪųĖČ©¾wĘeĄ─ę║¾wĢr(sh©¬)����Ż¼æ¬(y©®ng)Ž╚Ą╣╚ļĮėĮ³╦∙ąĶ¾wĘeĄ─ę║¾wŻ¼╚╗║¾Ė─ė├─zŅ^Ą╬╣▄Ą╬╝ėĪŻ╩╣ė├┴┐═▓Ģr(sh©¬)æ¬(y©®ng)ūóęŌŻ║ė├┴┐═▓┴┐╚Īę║¾w¾wĘe╩Ūę╗ĘN┤ų┬įĄ─ėŗ(j©¼)┴┐Ę©�Ż¼╦∙ęįį┌╩╣ė├ųą▒žĒÜ▀xė├║Ž▀mĄ─ęÄ(gu©®)Ė±Ż¼▓╗ę¬ė├┤¾┴┐═▓ėŗ(j©¼)┴┐ąĪ¾wĘe�����Ż¼ę▓▓╗ę¬ė├ąĪ┴┐═▓ČÓ┤╬┴┐╚Ī┤¾¾wĘeĄ─ę║¾w����Ż¼Ę±ätČ╝Ģ■(hu©¼)ę²Ų▌^┤¾Ą─š`▓ŅĪŻ┴┐═▓╩Ū║±▒┌╚▌Ų„�Ż¼Į^▓╗─▄ė├üĒ╝ė¤ß╗“┴┐╚Ī¤ßĄ─ę║¾w�����Ż¼ę▓▓╗─▄į┌Ųõųą╚▄ĮŌ╬’┘|(zh©¼)��ĪóŽĪßī║═╗ņ║Žę║¾wŻ¼Ė³▓╗─▄ė├ū÷Ę┤æ¬(y©®ng)╚▌Ų„ĪŻ
42.ę║¾wįć䮥─Ą╬╚Ī
ė├─zŅ^Ą╬╣▄╚Īė├ę║¾wįćä®Ģr(sh©¬)�Ż¼ę¬ūóęŌš²┤_Ą─ĘĮĘ©����Ż¼╚ńłD╦∙╩Š����ĪŻ╬³╚Īįćę║Ģr(sh©¬)Ž╚īóĄ╬╣▄╠ß│÷ę║├µ��Ż¼öD│÷─zŅ^ųąĄ─┐šÜŌ�Ż¼į┘░čĄ╬╣▄╔ņ╚ļįćę║ųą╬³╚ĪĪŻĄ╬╚ļįć╣▄Ģr(sh©¬)���Ż¼▓╗─▄░čĄ╬╣▄╔ņ╚ļįć╣▄ųą�Ż¼ęį├ŌĄ╬╣▄┼÷ĄĮįć╣▄▒┌Č°▒╗╬█╚Š����ĪŻ╬³ėąįć䮥─Ą╬╣▄▓╗┐╔Ą╣ų├Ż¼ęį├Ōįćä®┴„╚ļĄ╬Ņ^����ĪŻ
43.ØŌ╦ßĪóØŌēAĄ─╩╣ė├
ę“?y©żn)ķØŌ╦ß�ĪóØŌēAėąĖ»╬gąį����Ż¼╦∙ęį╩╣ė├Ģr(sh©¬)▒žĒÜ╠žäeąĪą─�����Ż¼Ę└ų╣š┤ĄĮŲż─w╔Ž╗“?y©żn)óį┌ę┬Ę■╔ŽĪ?/p>
╦ß┴„ĄĮū└├µ�����Ż¼æ¬(y©®ng)┴ó╝┤Ž“╦ßā╚(n©©i)╝ė▀m┴┐Ą─╠╝╦ßÜõŌc╚▄ę║�Ż¼ų▒ų┴▓╗į┘░l(f©Ī)╔·ÜŌ┼▌;ēAę║┴„ĄĮū└├µ���Ż¼æ¬(y©®ng)┴ó╝┤Ž“ēAā╚(n©©i)╝ė▀m┴┐ŽĪ┤ū╦ß����ĪŻ▀M(j©¼n)ąą╔Ž╩÷╠Ä└Ē║¾��Ż¼Ž╚ė├╦«ø_Ž┤ū└├µ���Ż¼į┘ė├─©▓╝▓┴Ė╔ā¶ĪŻ
Ųż─w╔ŽŠŲ╔ŽØŌ┴“╦ß�Ż¼▓╗ꬎ╚ė├╦«ø_Ž┤�����Ż¼Č°ę¬čĖ╦┘ė├▓╝įć╚źŻ¼į┘ė├╦«ø_Ž┤�����ĪŻŲõ╦³╦ßš┤į┌Ųż─w╔ŽŻ¼┴ó╝┤ė├┤¾┴┐╦«ø_Ž┤�ĪŻ╚╗║¾Č╝ę¬į┘═┐╔Ž3%—5%Ą─╠╝╦ßÜõŌc╚▄ę║;ēAš┤ĄĮŲż─w╔Ž����Ż¼ę▓ę¬ė├▌^ČÓĄ─╦«ø_Ž┤���Ż¼į┘═┐╔Ž┼╦ß╚▄ę║����ĪŻ
44.╣╠¾w╬’┘|(zh©¼)Ą─čą─ź
čą─ź╩ŪųĖ░č┴ŻĀŅ╣╠¾wĘ┼į┌čą└Åųąčą│╔Ę█─®Ą─▓┘ū„�ĪŻ
×ķ┴╦╝ė╦┘╬’┘|(zh©¼)Ą─╚▄ĮŌ╗“Ę┤æ¬(y©®ng)�Ż¼│Żė├┤╔Ą─╗“▓Ż┴¦čą└Å░č╬’┘|(zh©¼)čą╦ķ�Ż¼čą─źĢr(sh©¬)��Ż¼Ž╚░ččą└ÅĪóčąĶŲŽ┤ā¶┐½Ė╔�Ż¼ėę╩ų╬šūĪčąĶŲ�Ż¼Ž╚░č┤¾ēK╣╠¾wē║╦ķ�����Ż¼į┘╬šūĪčąĶŲė├▀ģē║▀ģ▐D(zhu©Żn)äė(d©░ng)čą─źĪŻ▓óļSĢr(sh©¬)ė├╦Ä│ū░čš┤į┌ĶŲ║═└Åā╚(n©©i)▒┌╔ŽĄ─╣╠¾w╣╬Ž┬üĒčą╦ķ�ĪŻčą─ź═Ļ«ģ║¾����Ż¼ė├╦Ä│ūīó╣╠¾wĘ█─®╚½▓┐╚Ī│÷���ĪŻ
▒╗čą─ź╣╠¾w┴┐▓╗ę¬│¼▀^╚▌ĘeĄ─1/3�����ĪŻ│▒رĄ─╣╠¾wę¬Įø(j©®ng)Ė╔į’Īó└õģs║¾į┘čą─ź�ĪŻÅŖ(qi©óng)č§╗»ä®Ą─╦ÄŲĘ└²╚ń┬╚╦ßŌø��Ż¼ų╗─▄ė├čąĶŲ▌p▌pē║╦ķ����Ż¼▓╗─▄ė├┴”čą─ź��Ż¼ęįĘ└ų╣▒¼š©╩┬╣╩ĪŻčą└Åė├═Ļ║¾æ¬(y©®ng)╝░Ģr(sh©¬)Ž┤ā¶����Īó┴└Ė╔����ĪŻ
45.╣╠¾w╬’┘|(zh©¼)Ą─╚▄ĮŌ
╣╠¾w╬’┘|(zh©¼)╚▄ĮŌĢr(sh©¬)���Ż¼Ž╚░čēKĀŅ╣╠¾wė├čą└Åē║╦ķ▓óčą╝Ü(x©¼)��ĪŻ×ķ╝ė┐ņ╚▄┘|(zh©¼)į┌╚▄ä®└’Ą─╚▄ĮŌ��Ż¼│Ż▓╔ė├╝ė¤ß�����Īóöć░Ķ��Īóš±╩ÄĄ╚ĘĮĘ©���ĪŻ
įć╣▄└’╦∙╩óĄ─╚▄┘|(zh©¼)║═╚▄ä®┐é┴┐▌^╔┘Ģr(sh©¬)�����Ż¼▓╗│¼▀^įć╣▄╚▌ĘeĄ─1/3ĪŻŠ═ė├š±╩ÄĄ─ĘĮĘ©���ĪŻė├ėę╩ųĄ──┤���Īó╩│Īóųą╚²ųĖ╬š│ųįć╣▄╔ŽČ╦����Ż¼¤o├¹ųĖ║═ąĪųĖÅØŽ“šŲą─����Ż¼ė├▀m«ö(d©Īng)┤¾ąĪĄ─═¾┴”üĒ╗ž╦”äė(d©░ng)įć╣▄�Ż¼š±╩ÄĢr(sh©¬)����Ż¼▓╗─▄╔ŽŽ┬š±╩Ä�Ż¼Ė³▓╗─▄ė├─┤ųĖČ┬ūĪįć╣▄┐┌���ĪŻ
¤²▒Ł└’╚▄ĮŌ╬’┘|(zh©¼)Ģr(sh©¬)Ż¼ė├▓Ż┴¦░¶į┌¤²▒Łųą└@╚”öćäė(d©░ng)�����Ż¼öćäė(d©░ng)Ģr(sh©¬)▓╗ę¬╩╣▓Ż┴¦░¶║═Ų„▒┌ū▓ō¶�����Ż¼ęįĘ└ų╣╚▌Ų„ŲŲ┴č���ĪŻ¤²▒ŁĄū▓┐Ą─╣╠¾w▓╗─▄ė├▓Ż┴¦░¶ōv╦ķŻ¼ęįĘ└ų╣ĶŲŲŲ▓Ż┴¦�����ĪŻ×ķĘ└ų╣öć░ĶĢr(sh©¬)▓Ż┴¦░¶┼÷ū▓¤²▒ŁŻ¼┐╔į┌▓Ż┴¦░¶ę╗Č╦╠ū╔Žę╗ąĪČ╬(1cmĪ½2cm)ŽŲż╣▄��Ż¼╩╣▓Ż┴¦░¶Ą─ĒöČ╦▓╗┬Č│÷�ĪŻ
¤²Ų┐╚▄ĮŌ╬’┘|(zh©¼)Ģr(sh©¬)Ż¼«ö(d©Īng)╚▄ę║▓╗│¼▀^¤²Ų┐╚▌Ęe1/2Ģr(sh©¬)�Ż¼ę▓┐╔ė├š±╩ÄĘĮĘ©╝ė╦┘╚▄┘|(zh©¼)Ą─╚▄ĮŌĪŻ
46.ØŌ┴“╦ߥ─ŽĪßī
ØŌ┴“╦ß╚▌ęū╚▄ė┌╦«����Ż¼═¼Ģr(sh©¬)Ę┼│÷┤¾┴┐¤ßŻ¼╦³Ą─├▄Č╚ėų┤¾ė┌╦«�����ĪŻ╚¶īó╦«ūó╚ļ╦ßųą��Ż¼╦«Ģ■(hu©¼)ĖĪį┌┴“╦ß╔Ž├µ����Ż¼╚▄ĮŌĢr(sh©¬)Ę┼│÷Ą─¤ßĢ■(hu©¼)╩╣╦«Ęą“vŻ¼╩╣┴“╦ߎ“╦─ų▄’w×R�Ż¼░l(f©Ī)╔·╩┬╣╩ĪŻę“┤╦ŽĪßīØŌ┴“╦ßĢr(sh©¬)���Ż¼ę╗Č©ę¬░čØŌ┴“╦ßčžų°Ų„▒┌┬²┬²Ąžūó╚ļ╦«└’��Ż¼▓ó▓╗öÓöćäė(d©░ng)�����Ż¼╩╣«a(ch©Żn)╔·Ą─¤ß┴┐čĖ╦┘Ąž?c©ói)U(ku©░)╔ó���ĪŻ
ÜŌ¾wĄ─╚▄ĮŌ
Ė∙ō■(j©┤)ÜŌ¾wį┌╦«╗“╬³╩šä®└’Ą─╚▄ĮŌąį▓╗═¼Ż¼┐╔▓╔ė├▓╗═¼Ą─ĘĮĘ©üĒ╬³╩šÜŌ¾w╩╣ų«╚▄ĮŌ�����ĪŻį┌╦«ųąśOęū╚▄ĮŌĄ─ÜŌ¾w╚ń░▒����Īó┬╚╗»Üõ�����ĪóõÕ╗»ÜõĄ╚æ¬(y©®ng)▓╔ė├BĘ©����Ż¼čbų├╠ž³c(di©Żn)╩Ūī¦(d©Żo)ÜŌ╣▄▀BĮė┴╦ę╗éĆ(g©©)Ą╣┐█Ą─┬®ČĘŻ¼┬®ČĘ▀ģŠēĮ■╚ļ╦«ųą╝s1mmĪ½2mm���ĪŻ╦³Ą─ā×(y©Łu)³c(di©Żn)╩Ū┐╔Ę└ų╣╦«Ą╣┴„╚ļÜŌ¾w░l(f©Ī)╔·čbų├����Ż¼ėų┐╔į÷┤¾╬³╩š├µĘeŻ¼└¹ė┌ÜŌ¾w│õĘų╚▄ĮŌĪŻ╦³ėąūįäė(d©░ng)š{(di©żo)╣Ø(ji©”)ÜŌ¾w░l(f©Ī)╔·čbų├ā╚(n©©i)═Ōē║┴”┌ģė┌ŲĮ║ŌĄ─ū„ė├ĪŻ╝┤ėąūį┐žĄ╣╬³ū„ė├�����ĪŻ╚ńÜŌ¾wĄ─╚▄ĮŌČ╚▓╗╠½┤¾����Ż¼╚ń┬╚ÜŌ����Īó┴“╗»ÜõĄ╚æ¬(y©®ng)▓╔╚ĪAĘ©�ĪŻ
47.╬’┘|(zh©¼)Ą─Ęųļx┼c╠ß╝ā
(1)ĘųļxŻ║░č╗ņ║Ž╬’ųąĖ„╬’┘|(zh©¼)▒╦┤╦Ęųķ_����Ż¼▓óīóĖ„╬’┘|(zh©¼)╗ųÅ═(f©┤)ĄĮįŁĀŅæB(t©żi)��ĪŻ
(2)╠ß╝āŻ║░č╗ņ║Ž╬’ųąļs┘|(zh©¼)│²╚źĪŻį┌╠ß╝ā▀^│╠ųą�����Ż¼╚ń╣¹ļs┘|(zh©¼)░l(f©Ī)╔·┴╦╗»īW(xu©”)ūā╗»����Ż¼▓╗▒ž╗ųÅ═(f©┤)│╔įŁ╬’┘|(zh©¼)���ĪŻ
ī”╬’┘|(zh©¼)▀M(j©¼n)ąąĘųļx╗“╠ß╝āĢr(sh©¬)����Ż¼æ¬(y©®ng)Ė∙ō■(j©┤)╬’┘|(zh©¼)╝░Ųõ╦∙║¼ļs┘|(zh©¼)Ą─ąį┘|(zh©¼)▀xė├▀mę╦Ą─ĘĮĘ©ĪŻ
╦─ĘN╬’┘|(zh©¼)╠ß╝āĘ©Ą─▒╚▌^
╬’┘|(zh©¼)╠ß╝āĘ©Ą─▀xō±
1.Ė∙ō■(j©┤)╬’┘|(zh©¼)ąį┘|(zh©¼)Ą─▓Ņ«É�����Ż¼▀xō±║Ž▀mĄ─╬’└ĒĘĮĘ©▀M(j©¼n)ąą╗ņ║Ž╬’Ą─Ęųļx(▀^×VĘ©�ĪóĮY(ji©”)Š¦Ę©)��ĪŻ▓ó─▄šŲ╬š▓┘ū„▓Į¾E╝░āxŲ„Ą─╩╣ė├����Ż¼ų¬Ą└╚▌ęū│÷Õe(cu©░)Ą─ĄžĘĮĪŻ(ęŖ▒Ē(1))
2.Ė∙ō■(j©┤)╬’┘|(zh©¼)ķgĄ─ŽÓ╗źĻP(gu©Īn)ŽĄ�����Ż¼▀\(y©┤n)ė├╗»īW(xu©”)ĘĮĘ©(╬³╩š�����Īó▐D(zhu©Żn)╗»)╩╣ļs┘|(zh©¼)│²╚źĪŻ(ęŖ▒Ē(2))
╬’┘|(zh©¼)Ą─╠ß╝ā▒Ē(1)
╬’┘|(zh©¼)Ą─╠ß╝ā▒Ē(2)
48.ÜŌ¾wĄ─ā¶╗»
ųĖĄ─╩ŪÜŌ¾w║═ÜŌ¾w╗“Ųõ╦³ļs┘|(zh©¼)Ą─ĘųļxĘĮĘ©ĪŻ▓╔ė├Ą─ĘĮĘ©╩Ūīó╗ņ║ŽÜŌ¾w═©▀^čbį┌Ž┤ÜŌŲ┐└’Ą──│įć䮥─╚▄ę║��Ż¼└¹ė├╦∙ąĶꬥ─ÜŌ¾w▓╗┼cįōįćä®Ę┤æ¬(y©®ng)�����Ż¼ę▓▓╗╚▄į┌╦«└’�Ż¼Č°Ųõ╦³▓╗ąĶꬥ─ÜŌ¾wļs┘|(zh©¼)Ż¼─▄║═įōįćä®Ę┤æ¬(y©®ng)╔·│╔ļyō]░l(f©Ī)Ą─╬’┘|(zh©¼)����Ż¼┴¶į┌Ž┤ÜŌŲ┐└’�����Ż¼▀_(d©ó)ĄĮĘųļxĄ──┐Ą─�ĪŻ
╬³╩šä®×ķę║¾wĄ─čbų├ĮąŽ┤ÜŌŲ┐ĪŻčb╚ļ┴┐1/3ų┴1/2����ĪŻ▀xō±╬³╩šä®æ¬(y©®ng)Å─▀@ÄūĘĮ├µ┐╝æ]Ż║ęū╚▄ė┌╦«Ą─╬’┘|(zh©¼)ė├╦«╬³╩š;╦ßąį╬’┘|(zh©¼)ė├ēAąį╬’┘|(zh©¼)╬³╩š;ė├┐╔┼cļs┘|(zh©¼)╔·│╔│┴ĄĒ╗“┐╔╚▄╬’Ą─╬³╩šä®╬³╩š;▓╗─▄ų▒Įė╬³╩š│²╚źļs┘|(zh©¼)Ż¼įO(sh©©)Ę©═©▀^ę╗Č©Ą─ūā╗»��Ż¼▐D(zhu©Żn)╗»│╔┐╔╬³╩šĄ─╬’┘|(zh©¼)ĪŻ
49.ÜŌ¾wĄ─Ė╔į’
│²╚źÜŌ¾wųąĄ─╦«š¶ÜŌĮąū÷ÜŌ¾wĄ─Ė╔į’��ĪŻ╩╣ė├╬³╩šä®×ķ╣╠æB(t©żi)Ą─čbų├ĮąĖ╔į’╣▄�����ĪóĖ╔į’╦■Ą╚�ĪŻ┐╔ė├ØŌ┴“╦ß�Ż¼ę▓┐╔ė├¤o╦«┬╚╗»Ō}ū„Ė╔į’䮥╚ĪŻĖ╔į’╣▄Ą─ė├Ę©����Ż¼┤ųČ╦×ķ▀M(j©¼n)┐┌Īó╝Ü(x©¼)Č╦×ķ│÷┐┌�����ĪŻĖ╔į’ä®▓╗─▄╠ŅĄ─▀^Šo����Ż¼╦³Ą─Ņw┴Ż┤¾ąĪę¬▀m«ö(d©Īng)Ż¼▓╗ę╦╠½┤¾����Ż¼ę▓▓╗ę╦╠½ąĪ��ĪŻĖ╔į’ä®æ¬(y©®ng)į┌╩╣ė├Ū░┼RĢr(sh©¬)╠Ņ│õ����Ż¼╗“Ę┼║µŽõųą╗“į┌Ė╔į’Ų„ųą▒Ż┤µ�ĪŻ
▀xō±Ė╔į’ä®ę¬Ė∙ō■(j©┤)ÜŌ¾wĄ─ąį┘|(zh©¼)Ż¼Ė╔į’ä®▓╗æ¬(y©®ng)║═▒╗Ė╔į’Ą─ÜŌ¾wĘ┤æ¬(y©®ng)����ĪŻ└²╚ńŻ¼Ė╔į’░▒ÜŌŠ═▓╗─▄ė├¤o╦«┬╚╗»Ō}���Ż¼æ¬(y©®ng)įōė├ēA╩»╗ę��ĪŻę“░▒─▄┼c┬╚╗»Ō}Ę┤æ¬(y©®ng)╔·│╔CaCl2·8NH3ĪŻ
Ė╔į’╣▄Ą╚ė├▀^║¾�Ż¼æ¬(y©®ng)┴ó╝┤░čĖ╔į’ä®ŪÕ│²│÷╚źŻ¼▓óŽ┤╦ó║¾Ę┼ų├����ĪŻ
50.īŹ(sh©¬)“×(y©żn)ųą░▓╚½Ą─ūóęŌ╩┬ĒŚ(xi©żng)
ó┘▓╗─▄ė├╩ųĮėė|╦ÄŲĘŻ¼▓╗ę¬░č▒Ū┐ū£ÉĄĮ╚▌Ų„┐┌╚ź┬ä╦ÄŲĘĄ─ÜŌ╬Č����Ż¼▓╗Ą├ćL╦ÄŲĘĄ─╬ČĄ└��ĪŻ
ó┌Į^ī”Į¹ų╣Ž“╚╝ų°Ą─ŠŲŠ½¤¶ā╚(n©©i)╠Ē╝ėŠŲŠ½���ĪŻ
ó█Į^ī”Į¹ų╣ė├ŠŲŠ½¤¶ę²╚╝┴Ēę╗ų╗ŠŲŠ½¤¶ĪŻ
ó▄╚fę╗ŠŲŠ½¤¶ā╚(n©©i)Ą─ŠŲŠ½×óį┌ū└╔Ž╚╝¤²ŲüĒ�����Ż¼æ¬(y©®ng)┴ó╝┤ė├ر▓╝╔w£ń����ĪŻ
ó▌ØŌ╦ß×óį┌ū└╔ŽĢr(sh©¬)Ż¼æ¬(y©®ng)┴ó╝┤ė├▀m┴┐Ą─╠╝╦ßŌc╚▄ę║ųą║═;ØŌēAę║ė├ŽĪ┤ū╦ßųą║═���Ż¼╚╗║¾ė├╦«ø_Ž┤���Ż¼ė├▓╝▓┴Ė╔ĪŻ╚ń╣¹ØŌ┴“╦ßš┤į┌Ųż─w╔Ž���Ż¼æ¬(y©®ng)Ž╚ė├▓╝▓┴╚ź�Ż¼į┘ė├╦«Ž┤����Ż¼╚╗║¾ė├3%Ī½5%Ą─╠╝╦ßÜõŌc╚▄ę║ųą║═����ĪŻ
ó▐ī”ė┌īŹ(sh©¬)“×(y©żn)ųąĄ─ėąČŠÜŌ¾w���Ż¼ę¬▓╔╚ĪŽÓæ¬(y©®ng)Ą─┤ļ╩®����Ż¼═©’L(f©źng)┼┼ČŠ�����Ż¼▒ŻūC╚╦¾wĄ─ĮĪ┐Ą���Ż¼Ę└ų╣Łh(hu©ón)Š│Ą─╬█╚Š���ĪŻ
ó▀³c(di©Żn)╚╝┐╔╚╝ąįÜŌ¾wŪ░ę╗Č©Ž╚įć“×(y©żn)╦³Ą─╝āČ╚ĪŻ
51.īŹ(sh©¬)“×(y©żn)╩ęųŲéõč§ÜŌ����ĪóÜõÜŌ║═Č■č§╗»╠╝╩╣ė├Ą─╦ÄŲĘ╝░Ę┤æ¬(y©®ng)įŁ└Ē
52.č§ÜŌ║═Č■č§╗»╠╝Ą─ÖzØMĘĮĘ©

53.č§ÜŌ����ĪóÜõÜŌ║═Č■č§╗»╠╝ųŲéõÜŌ¾wčbų├
(1)č§ÜŌė├╣╠¾w┼c╣╠¾w╦ÄŲĘ╗ņ║Ž╝ė¤ßĄ─čbų├
(2)ÜõÜŌ║═Č■č§╗»╠╝ė├╣╠¾w┼cę║¾w╦ÄŲĘ╗ņ║Ž▓╗╝ė¤ßĄ─čbų├
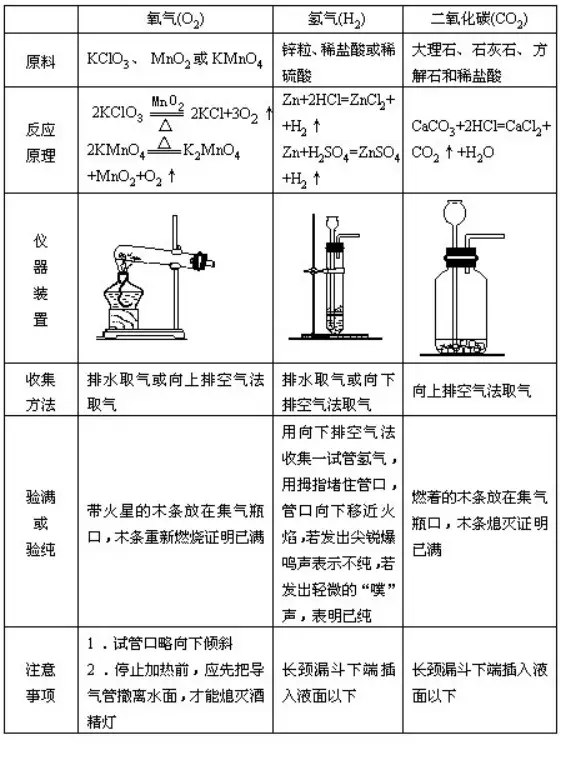
54.?īŹ(sh©¬)“×(y©żn)╩ęųŲ╚Īč§ÜŌ���ĪóÜõÜŌĪóČ■č§╗»╠╝Ą─▒╚▌^
55.╦ÄŲĘĄ─┤µĘ┼
░ū┴ūŻ║ę“ęūč§╗»Ūę─▄ūį╚╝����Ż¼Ą½╦³▓╗┼c╦«Ę┤æ¬(y©®ng)Ż¼╦∙ęįæ¬(y©®ng)Ę┼į┌╦«ųą┤µĘ┼��ĪŻ
ÅŖ(qi©óng)ēAŻ║╚ńÜõč§╗»Ōc���ĪóÜõč§╗»ŌøĄ╚����ĪŻę“╦³éāęū│▒ĮŌ���Īóęū┼cČ■č§╗»╠╝Ę┤æ¬(y©®ng)�Ż¼ėų─▄┼cČ■č§╗»╣ĶĘ┤æ¬(y©®ng)Č°Ė»╬gįćä®Ų┐Ų┐┐┌����Ż¼╦∙ęįæ¬(y©®ng)Ę┼į┌ė├─z╚¹├▄ĘŌĄ─įćä®Ų┐ā╚(n©©i)ĪŻ
ØŌŽ§╦߯║ę“Š▀ėąō]░l(f©Ī)ąį����Ż¼ęŖ╣Ō╩▄¤ßęūĘųĮŌ����Ż¼æ¬(y©®ng)į┌Ą═£ž╠ÄĄ─ūž╔½Ų┐ā╚(n©©i)┤µĘ┼���ĪŻ
░▒╦«Ż║ę“ęūō]░l(f©Ī)�����Ż¼╦∙ęįæ¬(y©®ng)Ę┼į┌Ą═£ž╠Ä�����Ż¼├▄ĘŌį┌įćä®Ų┐ā╚(n©©i)�ĪŻ░▒╦«ī”ČÓĘNĮī┘ėąĖ»╬gū„ė├����Ż¼į┌▀\(y©┤n)▌ö║═┘A┤µ░▒╦«Ģr(sh©¬)Ż¼ę╗░Ńę¬ė├ŽŲż┤³����Īó╠š┤╔ē»╗“ā╚(n©©i)═┐×rŪÓĄ─ĶF═░Ą╚─═Ė»╬gĄ─╚▌Ų„ĪŻ
Įī┘Ōø����ĪóŌcĪóŌ}Ż║ę“╦³éāęūč§╗»�����ĪóęūĖ·╦«Ę┤æ¬(y©®ng)���Ż¼Ą½╦³éā▓╗║═├║ė═╗“╩»Ž×ė═Ę┤æ¬(y©®ng)���Ż¼╦∙ęįæ¬(y©®ng)į┌├║ė═╗“╩»Ž×ė═└’┤µĘ┼ĪŻ
Ž§╦ßŃyŻ║ę“ęŖ╣Ō╩▄¤ßęūĘųĮŌ����Ż¼╦∙ęįæ¬(y©®ng)į┌Ą═£ž╠Äūž╔½Ų┐ā╚(n©©i)┤µĘ┼ĪŻ
ØŌ┴“╦ßęū╬³╩š┐šÜŌųąĄ─╦«Ę▌��Ż¼ØŌ¹}╦ßęūō]░l(f©Ī)���Ż¼æ¬(y©®ng)Ę┼╚ļįćä®Ų┐└’ė├─ź┐┌╚¹╔wć└(y©ón)�ĪŻ
56.Öz“×(y©żn)╬’┘|(zh©¼)Ą─ę╗░ŃęÄ(gu©®)ät
(1)Ė„╚Ī╔┘┴┐����Ż¼ĘųäeŠÄ╠¢;
(2)╣╠¾w╬’┘|(zh©¼)╝ė╦«╚▄ĮŌ;
(3)ĘųäeĄ╬╝ėįćä®;
(4)ė^▓ņ¼F(xi©żn)Ž¾Ż¼Ą├│÷ĮY(ji©”)šōĪŻ
57.╚²ĘNÜŌ¾w(č§ÜŌ��ĪóÜõÜŌ║═Č■č§╗»╠╝)Ą─Öz“×(y©żn)
58.ÄūĘNųžę¬╬’┘|(zh©¼)Ą─Öz“×(y©żn)
ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖC(j©®)�ĪóŲĮ░ÕĄ╚ęŲäė(d©░ng)įO(sh©©)éõįLå¢ųą┐╝ŠW(w©Żng)Ż¼2024ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąą�����ŻĪ>>³c(di©Żn)ō¶▓ķ┐┤