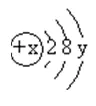原子的構(gòu)成
⒈構(gòu)成原子的粒子

⒉在原子里,核電荷數(shù)=質(zhì)子數(shù)=核外電子數(shù),原子不顯電性��。
考點(diǎn)2 相對(duì)原子質(zhì)量
⒈相對(duì)原子質(zhì)量的標(biāo)準(zhǔn):碳-12原子質(zhì)量的1/12。
⒉表達(dá)式:Ar=其他原子的質(zhì)量/(碳-12的質(zhì)量×1/12)
相對(duì)原子質(zhì)量是一個(gè)比值�����,不是原子的實(shí)際質(zhì)量。
⒊原子的質(zhì)量主要集中在原子核上�����,相對(duì)原子質(zhì)量≈質(zhì)子數(shù)+中子數(shù)
考點(diǎn)3 元素
⒈元素的定義:具有相同核電荷數(shù)(即核內(nèi)質(zhì)子數(shù))的一類原子的總稱�。
⒉元素的種類決定于核電荷數(shù)(即核內(nèi)質(zhì)子數(shù))。
⒊地殼中含量列前四位的元素(質(zhì)量分?jǐn)?shù)):氧�����、硅�����、鋁��、鐵�����,其中含量最多的元素(非金屬元素)是氧���,含量最多的金屬元素是鋁。
⒋生物細(xì)胞中含量列前四位的元素:氧���、碳����、氫、氮��。
考點(diǎn)4 元素符號(hào)
⒈元素符號(hào):用元素的拉丁文名稱的第一個(gè)大寫字母來元素��。
⒉書寫:
⑴由一個(gè)字母表示的元素符號(hào)要大寫����,如:H、O�、S、C����、P等。
⑵由兩個(gè)字母表示的元素符號(hào)�,第一個(gè)字母要大寫,第二個(gè)字母要小寫(即“一大二小”)���,如:Ca��、Na��、Mg�、Zn等。
⒊元素符號(hào)表示的意義:⑴表示一種元素;⑵表示這種元素的一個(gè)原子�。例如:
H:①表示氫元素
②表示一個(gè)氫原子
2H:表示二個(gè)氫原子,2H不能說成二個(gè)氫元素
注意:元素只講種類����,不講個(gè)數(shù);原子即講種類,又講個(gè)數(shù)���。
考點(diǎn)5 物質(zhì)組成�、構(gòu)成的描述
⒈物質(zhì)由元素組成:如水是由氫元素和氧元素組成的��。
⒉物質(zhì)由粒子(分子�、原子����、離子)構(gòu)成。例如:
⑴水是由水分子構(gòu)成的���。
⑵金是由金原子構(gòu)成的����。
⑶氯化鈉是由鈉離子和氯離子構(gòu)成的。
⒊分子是由原子構(gòu)成的����。
如:水分子是由氫原子和氧原子構(gòu)成的;每個(gè)水分子是由二個(gè)氫原子和一個(gè)氧原子構(gòu)成的。
考點(diǎn)6 元素周期表簡(jiǎn)介
⒈元素周期表

⑴周期表每一橫行叫做一個(gè)周期�,共有7個(gè)周期。
⑵周期表每一個(gè)縱行叫做一族��,共有16個(gè)族(8���、9��、10三個(gè)縱行共同組成一個(gè)族)��。
⒉元素周期表的意義
⑴是學(xué)習(xí)和研究化學(xué)知識(shí)的重要工具;
⑵為尋找新元素提供了理論依據(jù);
⑶由于在元素周期表中位置越靠近的元素�,性質(zhì)越相似�����,可以啟發(fā)人們?cè)谠刂芷诒淼囊欢▍^(qū)域?qū)ふ倚挛镔|(zhì)(如農(nóng)藥�、催化劑、半導(dǎo)體材料等)��。
考點(diǎn)7 核外電子的分層排布
⒈電子排布——分層排布:第一層不超過2個(gè);第二層不超過8個(gè);……最外層不超過8個(gè)����。
⒉原子結(jié)構(gòu)示意圖:
⑴含義:(以鎂原子結(jié)構(gòu)示意圖為例)
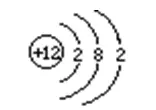
⑵原子的最外層電子數(shù)與元素的分類���、化學(xué)性質(zhì)的關(guān)系

①元素的化學(xué)性質(zhì)決定于原子的最外層電子數(shù)。
②原子最外層電子數(shù)為8(氦為2)的結(jié)構(gòu)稱為穩(wěn)定結(jié)構(gòu)�����。
⑶原子����、陽離子、陰離子的判斷
① 原子:質(zhì)子數(shù)=核外電子數(shù)
② 陰離子:質(zhì)子數(shù)<核外電子數(shù)
③ 陽離子:質(zhì)子數(shù)>核外電子數(shù)
考點(diǎn)8 離子
⒈定義:帶電荷的原子(或原子團(tuán))���。
⒉分類(注:本文中加減均為上標(biāo))
陽離子:帶正電荷的離子���,如Na+、Mg2+
陰離子:帶負(fù)電荷的離子�����,如Cl-�����、O2-
⒊離子符號(hào)表示的意義:表示離子(或一個(gè)離子)����,如:Mg2+——表示鎂離子(一個(gè)鎂離子)
2Mg2+ ——第一個(gè)2表示兩個(gè)鎂離子
第二個(gè)2表示每個(gè)鎂離子帶兩個(gè)單位的正電荷
⑴離子符號(hào)前面的化學(xué)計(jì)量數(shù)(系數(shù))表示離子的個(gè)數(shù);
⑵離子符號(hào)的表示方法:在元素符號(hào)(或原子團(tuán))右上角表明離子所帶的電荷,數(shù)值在前�,正、負(fù)號(hào)在后�。離子帶1個(gè)單位的正電荷或個(gè)單位的負(fù)電荷,“1”省略不寫���。如: 陽離子:Na+���、Ca2+、Al3+等��,陰離子:Cl-���、S2‑等
⒋有關(guān)離子的小結(jié)
⑴金屬離子帶正電荷��,非金屬離子帶負(fù)電荷;
⑵離子所帶的電荷=該元素的化合價(jià)
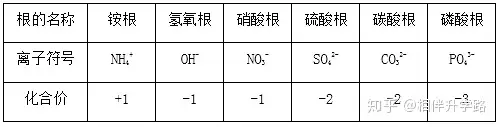
⑶常見原子團(tuán)離子(請(qǐng)注意上下標(biāo))
SO42- 硫酸根離子 CO32- 碳酸根離子
NO3- 硝酸根離子 OH- 氫氧根離子
NH4+ 銨根離子
考點(diǎn)9 化學(xué)式
⒈化學(xué)式的寫法
A.單質(zhì)的化學(xué)式
⑴雙原子分子的化學(xué)式�����,如:氫氣——H2�����,氧氣——O2�,氮?dú)?mdash;—N2,氯氣——Cl2����。
⑵稀有氣體����、金屬與固體非金屬單質(zhì):由原子構(gòu)成����,它們的化學(xué)式用元素符號(hào)來表示。
B.化合物的化學(xué)式
正價(jià)寫左邊���,負(fù)價(jià)寫右邊��,同時(shí)正���、負(fù)化合價(jià)的代數(shù)和為零。
⒉幾點(diǎn)注意事項(xiàng)
⑴一種物質(zhì)只有一個(gè)化學(xué)式��,書寫化學(xué)式時(shí)�����,要考慮到元素的排列順序���,還要考慮到表示原子個(gè)數(shù)的角碼應(yīng)寫的部位����。
⑵一般化合物的中文名稱��,其順序和化學(xué)式書寫的順序正好相反�。
⒊化學(xué)式的涵義(以CO2為例說明)
⑴宏觀上
表示一種物質(zhì):表示二氧化碳。
表示該物質(zhì)由哪些元素組成:表示二氧化碳由碳元素和氧元素組成�。
⑵微觀上
表示該物質(zhì)的一個(gè)分子:表示一個(gè)二氧化碳分子。
表示分子的構(gòu)成:表示每個(gè)二氧化碳分子由一個(gè)碳原子和二個(gè)氧原子構(gòu)成����。
考點(diǎn)10 化合價(jià)
⒈元素化合價(jià)的表示方法
化合價(jià)用+1����、+2����、+3、-1����、-2……表示,標(biāo)在元素符號(hào)的正上方���,如:Na��、 Cl�、 Mg����、 O。要注意化合價(jià)的表示方法與離子符號(hào)的區(qū)別���,離子所帶電荷符號(hào)用+�、2+、-�����、2-……表示����,標(biāo)在元素符號(hào)的右上角���,如:
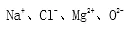
⒉元素化合價(jià)的一般規(guī)律
⑴氫元素的化合價(jià)通常顯+1價(jià)�����,氧元素的化合價(jià)顯-2價(jià)���。
⑵在化合物中,金屬元素為正價(jià)��。
⑶非金屬與氫或金屬化合時(shí)�,非金屬元素顯負(fù)價(jià);非金屬與氧元素化合時(shí),非金屬元素顯正價(jià)����。
⑷在化合物中,正、負(fù)化合價(jià)的代數(shù)和為零���。
⑸在單質(zhì)中元素的化合價(jià)為零����。
⒊牢記常見元素的化合價(jià)
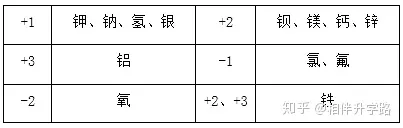
⒋常見根(原子團(tuán))的化合價(jià)
常見元素的化合價(jià)(正價(jià)):
一價(jià)鉀鈉氫與銀�����,二價(jià)鈣鎂鋇與鋅��,三價(jià)金屬元素鋁;
一五七變價(jià)氯�,二四五氮,硫四六�,三五有磷,二四碳;
一二銅�,二三鐵,二四六七錳特別���。
⒌化合價(jià)的應(yīng)用
⑴檢驗(yàn)化學(xué)式的正誤;
⑵根據(jù)化學(xué)式判斷元素的化合價(jià);
⑶根據(jù)元素的化合價(jià)推求實(shí)際存在物質(zhì)的化學(xué)式��。
考點(diǎn)11 有關(guān)化學(xué)式的計(jì)算
⒈計(jì)算物質(zhì)的相對(duì)分子質(zhì)量=各元素的相對(duì)原子質(zhì)量×原子個(gè)數(shù)之和
⒉計(jì)算物質(zhì)組成元素的質(zhì)量比=各元素的相對(duì)原子質(zhì)量×原子個(gè)數(shù)之比
⒊計(jì)算物質(zhì)中某元素的質(zhì)量分?jǐn)?shù)
物質(zhì)中某元素的質(zhì)量分?jǐn)?shù)=(該元素的相對(duì)原子質(zhì)量×原子個(gè)數(shù))÷化合物的相對(duì)分子質(zhì)量×100%
⒋計(jì)算一定質(zhì)量的化合物中含某元素的質(zhì)量
某元素的質(zhì)量=化合物的質(zhì)量×化合物中該元素的質(zhì)量分?jǐn)?shù)
變形:化合物的質(zhì)量=某元素的質(zhì)量÷化合物中該元素的質(zhì)量分?jǐn)?shù)
⒌已知化合物中各元素的質(zhì)量比和各元素的相對(duì)原子質(zhì)量�����,求原子個(gè)數(shù)比
各元素的原子個(gè)數(shù)比=各元素的質(zhì)量/各元素的相對(duì)原子質(zhì)量之比
檢測(cè)題
一��、選擇題(本題共10小題���,每小題只有一個(gè)選項(xiàng)符合題意����。每小題2分����,共20分)
1.在地震后的救援行動(dòng)中����,為了搜索埋在廢墟中的幸存者,人們用了搜救犬����,搜救犬能根據(jù)人體發(fā)出的氣味發(fā)現(xiàn)幸存者。試用化學(xué)觀點(diǎn)從微粒的角度分析能發(fā)現(xiàn)幸存者的原因是( )
A.分子在不斷運(yùn)動(dòng) B.分子間有間隔
C.分子的體積很小 D.分子的質(zhì)量很小
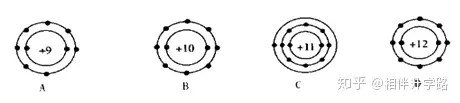
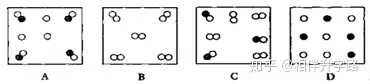
2.下列選項(xiàng)中代表離子的是(說明:數(shù)字代表質(zhì)子數(shù)�,“+”表示原子核所帶的電荷,黑點(diǎn)代表核外電子) ( )
3.分子和原子的根本區(qū)別是( )
A.分子比原子大
B.分子可分���,原子不可分
C.在化學(xué)變化中�����,分子可以再分�����,原子不能再分
D.分子可以構(gòu)成物質(zhì)��,原子不能構(gòu)成物質(zhì)
4.下列各組原子結(jié)構(gòu)示意圖中���,所表示的兩種元素具有相似化學(xué)性質(zhì)的是 ( )
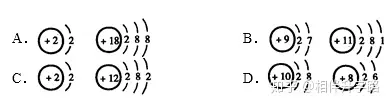
5.能證明分子在化學(xué)反應(yīng)中可以再分的事實(shí)是( )
A.氧化汞 受熱分解 B.用自來水制蒸餾水
C.分離空氣法制氧氣 D.碘升華為碘蒸氣
6.下列操作能將物質(zhì)完全分散成 分子的是BC未學(xué)到 ( )
A.在研缽里用杵研磨粒狀膽礬 B.將蔗糖溶于水
C.把植物油滴入水中用力振蕩 D.加熱高錳酸鉀
7.A�����、B����、C三只小燒杯內(nèi)依次盛有一定體積的濃氨水�����、酚酞溶液��、酚酞溶液��,按圖所示進(jìn)行探究活動(dòng),不能得到的結(jié)論是( )
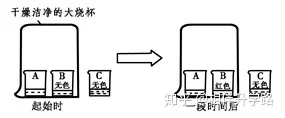
A. 氨分子是不斷運(yùn)動(dòng)的
B. 堿能使酚酞溶液變紅
C. 空氣不能使酚酞溶液變紅
D.氨分子溶于水�����,形成氨水使酚酞溶液變紅
8.下列對(duì)生產(chǎn)���、生活現(xiàn)象的解釋正確的是( )
A.鋁錠難被壓縮���,因?yàn)殇X原子間沒有間隙
B.溫度計(jì)里的汞柱下降,因?yàn)樵与S溫度的降低而變小
C.石油氣加壓后貯存在鋼瓶中�,因?yàn)闅怏w分子體積很小
D.氧氣和液氧都可以助燃�����,因?yàn)橄嗤镔|(zhì)的分子���,其化學(xué)性質(zhì)相同
9.某些花崗巖石材中含有放射性元素氡�,一種氡原子的質(zhì)子數(shù)為86��,中子數(shù)為136����,這種氡原子的核外電子數(shù)為( )
A.50 B.86
C.136 D.222
10.元素周期表是學(xué)習(xí)化學(xué)的重要工具��。右圖是元素周期表中的一格�,從中獲取的信息錯(cuò)誤的是( )
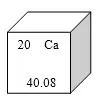
A.該元素的原子序數(shù)為20
B.該元素屬于非金屬元素
C.該元素的原子核外有20個(gè)電子
D.該元素的相對(duì)原子質(zhì)量為40.08
二�����、選擇題(本題共5小題�,每小題有一個(gè)或兩個(gè)選項(xiàng)符合題意。錯(cuò)選�、多選不給分。有兩個(gè)答案的�����,只選一個(gè)且正確�,給2分。每小題3分��,共15分)
11.十九世紀(jì)初����,意大利科學(xué)家阿伏加德羅在總結(jié)前人工作的基礎(chǔ)上,提出了分子的概念���,他認(rèn)為:①一切物質(zhì)都是由分子構(gòu)成的;②分子由原子構(gòu)成;③原子不能獨(dú)立存在;④分子是保持物質(zhì)化學(xué)性質(zhì)的最小粒子;⑤分子的質(zhì)量等于組成它的原子的質(zhì)量之和;⑥分子在不停地運(yùn)動(dòng)�。從你所學(xué)的知識(shí)看,上述觀點(diǎn)存在明顯不足的是 ( )
A.①③ B.①②⑤
C.④⑤⑥ D.③⑤
12.下列關(guān)于Fe����、Fe2+、Fe3+的說法中�����,正確的是( )
A.它們的質(zhì)子數(shù)不同
B.它們的最外層電子數(shù)相同
C.它們的核外電子數(shù)不同
D.它們屬于同一種元素
13.下圖是氣體物質(zhì)的粒子示意圖���,圖中“ ”和“ ”分別表示兩種不同的原子��,其中表示純凈物的是( )
14.化學(xué)上常用元素符號(hào)左下角的數(shù)字表示原子的質(zhì)子數(shù)��,左上角的數(shù)字表示原子的中子數(shù)與質(zhì)子數(shù)之和����,如用 C表示核內(nèi)有6個(gè)質(zhì)子和7個(gè)中子的碳原子�����。則 Cl和 Cl( )
A.原子核內(nèi)質(zhì)子數(shù)目不同
B.屬于同種元素
C.原子中核外電子數(shù)相同
D.原子核內(nèi)中子數(shù)目相同
15.兩位美國(guó)科學(xué)家彼得·阿格雷和羅得里克·麥金農(nóng)�,因?yàn)榘l(fā)現(xiàn)細(xì)胞膜水通道��,以及對(duì)離子通道結(jié)構(gòu)和機(jī)理研究作出的開創(chuàng)性貢獻(xiàn)而獲得2003年諾貝爾化學(xué)獎(jiǎng)。他們之所以獲得諾貝爾化學(xué)獎(jiǎng)而不是生理學(xué)或醫(yī)學(xué)獎(jiǎng)是( )
A.他們的研究和化學(xué)物質(zhì)水有關(guān)
B.他們的研究有利于研制針對(duì)一些 神經(jīng)系統(tǒng)疾病和心血管疾病的藥
C.他們的研究深入到分子�����、原子的層次
D.他們的研究深入到細(xì)胞的層次
三����、填空題(本題包括10小題。(17����、21、25每空2分�����,其余每空1分�,共65分)
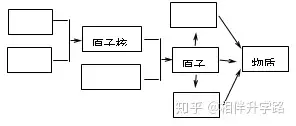
16.(5分)通過學(xué)習(xí)我們對(duì)“物質(zhì)構(gòu)成的奧秘 ”已有一定的了解。請(qǐng)?jiān)谟覉D方框中填寫粒子名稱�,表示各種粒子是怎樣構(gòu)成物質(zhì)的。
17.(6分)用分子原子的觀點(diǎn)解釋下列現(xiàn)象:
(1)濕衣服晾在太陽曬著的地方更容易干���。
(2)1L酒精和1L水混合����,總體積小于2L。
(3)溫度計(jì)里的水銀受熱體積膨脹��。
18.(8分)按要求寫出下列物質(zhì)的化學(xué)式(各寫2個(gè)):
(1)由分子構(gòu)成的物質(zhì) _____;
(2)由原子直接構(gòu)成的物質(zhì)_____;
(3)由離子構(gòu)成的物質(zhì)______ ;
(4)同種元素組成的不同物質(zhì)_____;
19.(6分)在①分子��、②原子��、③質(zhì)子��、④中子�、⑤電子、⑥離子這些微粒中:
(1)能構(gòu)成物質(zhì)的微粒有__________;
(2)顯電中性的微粒有______ ______;
(3)質(zhì)量最小的微粒是____________;
(4)一定帶正電荷的微粒有____ ______;
(5)一定帶負(fù)電的微粒有__________;
(6)可能帶正電也可能帶負(fù)電的是_____ ����。
20.(10分)右圖是某粒子的結(jié)構(gòu)示意圖,回答下列問題:
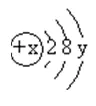
(1)x表示_____�����,它決定元素的_____����,y表示_____ �����,它決定元素的_____,該元素位于元素周期表第_____周期��。
(2)當(dāng)x=12時(shí)�����,y=_____����,該粒子為原子。
(3)當(dāng)x=17時(shí)�����,該粒子帶1個(gè)單位負(fù)電荷��,則y=___���。
(4)當(dāng)y=1時(shí)���,該粒子易_______電子,變成帶_____電荷的_________����。
21.(6分)右圖為氧化汞受熱分解的微觀過程示意圖�����。
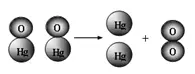
從圖示中能總結(jié)出哪些規(guī)律(至少寫3條):
(1)_________________�。
(2)_________________��。
(3)_________________�����。
22.(5分)2011年3月11日下午��,日本宮城縣發(fā)生里氏9.0級(jí)大地震�����,引發(fā)的海嘯導(dǎo)致福島核電站發(fā)生重大核事故���。
(1)核電站中核燃料鈾或钚在中子的撞擊下�,原子核發(fā)生分裂����,產(chǎn)生鋇��、氙、碘���、銫�����、鍶等原子和一些粒子及射線�����,同時(shí)釋放大量的能量�����,這些能量可用于驅(qū)動(dòng)汽輪機(jī)發(fā)電�����。
①從物質(zhì)的變化上看��,核變化與化學(xué)變化的相同點(diǎn)是 _____;從原子的變化上看����,核變化與化學(xué)變化的不同點(diǎn)是_____。
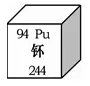
②右圖為元素周期表中钚元素的相關(guān)信息��,下列說法正確的是_____���。
A.钚是金屬元素 B.钚原子核外有94個(gè)電子
C.钚元素的中子數(shù)94 D.钚的相對(duì)原子質(zhì)量為244g
(2)針對(duì)日本核泄漏事故給人類帶來的災(zāi)難��,有同學(xué)提出如下看法:“科學(xué)技術(shù)給人類進(jìn)步帶來了貢獻(xiàn)�,也帶來了災(zāi)難��,可見�����,科學(xué)技術(shù)對(duì)人類發(fā)展并沒有太大意義����。”你是否同意此看法,請(qǐng)談?wù)勀愕挠^點(diǎn)����。
23.(6分)試依據(jù)核電荷數(shù)為1~18的元素的原子結(jié)構(gòu)示意圖,回答下列問題:
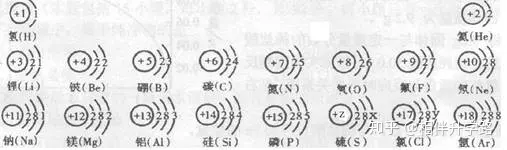
(1)上圖中硫元素的核電荷數(shù)z=_______;氯元素的最外層電子數(shù)y=______(填數(shù)值)���,則與氯元素化 學(xué)性質(zhì)相似的元素是______��。
(2)核電荷數(shù)為12的元素的原子失去兩個(gè)電子后��,形成的粒子的符號(hào)是______�����,它的核外電子排布與_______元素的原子核外電子排布相同�����。
(3)上圖的排列具有一定的規(guī)律�����,如:同一行中���,從左到右元素的核電荷數(shù)依次增加。你還能找到哪些規(guī)律?試寫出其中一個(gè):
_________________________________________
24.(5分)下圖是1~18號(hào)元素原子最外層電子數(shù)與原子核電荷數(shù)的關(guān)系圖����。
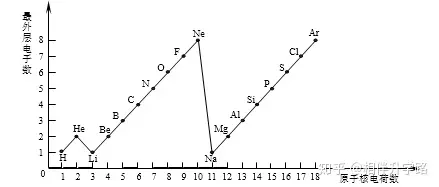
試回答:
(1)一個(gè)水分子共有____個(gè)原子核、____個(gè)質(zhì)子����。
(2)一個(gè)Mg2+核外共有____個(gè)電子���,Cl—的最外層電子數(shù)和____原子的最外層電子數(shù)相同。
(3)通過上圖你能發(fā)現(xiàn)哪些規(guī)律?請(qǐng)寫出其中一個(gè):
__________________________________ �。
25.(8分)右下圖是從空氣中分離氧氣的示意圖:請(qǐng)你寫出從圖中所獲得的有關(guān)物質(zhì)組成、結(jié)構(gòu)���、性質(zhì)����、變化等信息各一條:
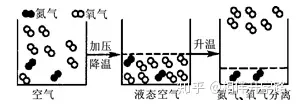
組成:_____________�。
結(jié)構(gòu):_____________。
性質(zhì):_____________��。
變化:_____________��。

歡迎使用手機(jī)�、平板等移動(dòng)設(shè)備訪問中考網(wǎng),2023中考一路陪伴同行�!>>點(diǎn)擊查看